บทสรุป
พิษของสารปรอทขึ้นกับลักษณะรูปแบบ วิธีการ และปริมาณที่ได้รับเข้าสู่ร่างกาย การลดการใช้สารปรอทเป็นประโยชน์ต่อมวลมนุษยชาติทั้งในด้านการลดการรับเข้าสู่ร่างกาย และลดผลต่อสิ่งแวดล้อม อย่างไรก็ดี จนถึงปัจจุบัน ยังไม่สามารถหาข้อสรุปและหลักฐานทางวิทยาศาสตร์ที่เด่นชัดหนักแน่นและเป็นที่ยอมรับได้ว่าอะมัลกัมส่งผลเสียต่อสุขภาพ การใช้วัสดุอะมัลกัมบูรณะฟันไม่ได้เพิ่มความเสี่ยงต่อการเกิดโรค ต่อสุขภาพ หรือผลข้างเคียงไม่พึงประสงค์ทางร่างกายต่อผู้ป่วย มีการพบการตอบสนองเฉพาะที่ (local adverse effects) ได้บ้างแต่ไม่มากนัก และสามารถจัดการรักษาได้โดยไม่ยุ่งยาก
ในกลุ่มสตรีมีครรภ์และทารก แม้ปรอทจะสามารถผ่านแนวกั้นระหว่างเลือดและสมอง รวมถึงรกได้ หลักฐานจากการศึกษาที่มี ไม่พบความสัมพันธ์ระหว่างการได้รับสารปรอทจากอะมัลกัมกับการเกิดผลข้างเคียงระหว่างตั้งครรภ์และน้ำหนักแรกคลอดของทารก รวมถึงไม่พบผลกระทบต่อทารกจากการได้รับนมมารดาที่มีวัสดุอะมัลกัมในช่องปาก สำหรับการศึกษาทางคลินิกในเด็กอายุต่ำกว่า 6 ปีที่มีวัสดุอุดอะมัลกัมในช่องปากมีไม่มากนัก และไม่พบผลกระทบต่อพัฒนาการ การทำงานของสมองและระบบประสาทจากการได้รับปรอทจากวัสดุอะมัลกัม ส่วนในกลุ่มประชากรเด็กที่มีอายุ 6 ปีขึ้นไปที่มีวัสดุอะมัลกัมในช่องปาก ปริมาณปรอทที่วัดได้อยู่ในระดับต่ำกว่าเกณฑ์ที่จะส่งผลอันตรายต่อสุขภาพ อย่างไรก็ดี หากสตรีมีครรภ์จำเป็นต้องรับการบูรณะฟัน ทันตแพทย์ควรเลือกวิธีการและวัสดุในการบูรณะฟัน โดยพิจารณาองค์ประกอบต่าง ๆ เช่น ประวัติสุขภาพ ได้แก่ ความดัน การทำงานของไต อายุของครรภ์ ประวัติการแพ้อะมัลกัม/วัสดุ/สารเคมี เป็นต้น ส่วนการบูรณะฟันในเด็กควรพิจารณาองค์ประกอบต่าง ๆ เช่น ประวัติสุขภาพ ชนิดของฟัน (ฟันน้ำนม หรือ ฟันแท้) ระยะเวลาที่ฟันจะคงอยู่ในช่องปาก จำนวนฟันที่ต้องรักษา เป็นต้น ดังนั้น การบูรณะฟันในสตรีมีครรภ์และเด็ก ทันตแพทย์สามารถใช้ทันตวัสดุ ทั้งอะมัลกัมหรือวัสดุทางเลือกตามข้อบ่งชี้ โดยทันตแพทย์ควรแจ้งผลดี ผลเสีย และผลข้างเคียงที่ไม่พึงประสงค์ของวัสดุที่จะใช้ในการรัษา เพื่อให้สตรีมีครรภ์และผู้ปกครองพิจารณา
ในส่วนของทันตบุคคลากร เป็นที่ยอมรับว่าได้รับสารปรอทมากกว่าคนทั่วไปเพราะเป็นการได้รับต่อเนื่องจากสายอาชีพ อย่างไรก็ดี การรายงานเรื่องผลกระทบต่อสุขภาพ ไม่ได้พบว่ามีความแตกต่างไปจากประชากรทั่วไป มาตรการระมัดระวังการใช้สารปรอทที่ใช้ในผู้ป่วย ก็ควรนำมาใช้กับทันตบุคคลากรด้วยเช่นกัน โดยเฉพาะอย่างยิ่งเรื่องการจัดการสารปรอทในการบูรณะฟัน รวมตั้งแต่การจัดเก็บ การจัดเตรียม ระหว่างขั้นตอนการบูรณะ การจัดการขยะอะมัลกัม และขั้นตอนการรื้ออะมัลกัมต้องทำอย่างระมัดระวังในผู้ป่วยทุกคน เช่น ต้องใส่แผ่นยางกันน้ำลาย ใช้ water coolant และ high power suction เป็นต้น
การลดการใช้สารปรอทลงเพื่อตอบสนองต่ออนุสัญญามินามาตะเป็นการช่วยลดสารปรอทเข้าสู่สิ่งแวดล้อม
ปรอท (Mercury) และ ผลกระทบของสารปรอทต่อสุขภาพโดยรวม
ปรอทเป็นโลหะหนักที่มีการนำมาใช้ทั้งในอุตสาหกรรม ชีวิตประจำวัน และปนเปื้อนอยู่ในสิ่งแวดล้อมมานานแล้ว ซึ่งประชาชนทั่วไปและบุคลากรทางการแพทย์ทราบถึงพิษและผลข้างเคียงของปรอท และมีการปรับปรุงและเปลี่ยนแปลงเพื่อลดพิษและผลข้างเคียงดังกล่าว ปรอทมี 3 รูปแบบ คือ โลหะปรอท (elemental mercury) ปรอทอนินทรีย์ (inorganic mercury) และ ปรอทอินทรีย์ (organic mercury) ปรอทพบได้ในสิ่งแวดล้อมตามธรรมชาติ จาก earth crusts, fossil fuel, industrial dusts ผลจากการใช้ amalgam fillings, thermometers ในห่วงโซ่อาหาร ในผลิตภัณฑ์ ทางอุตสาหกรรม เช่น chlor-alkali, lighting, batteries, electrical switches, insulators, tobacco, paints เป็นต้น
ปรอทสามารถเข้าสู่ร่างกายได้ 3 ทางคือ
1. การสูดดมไอปรอท เป็นเส้นทางหลักในการสัมผัสกับปรอท ไอของปรอทที่สูดดมสามารถดูดซึมโดยปอดถึง 80%โดยประมาณ การหายใจรับไอปรอทเข้าสู่ระบบหายใจจะทำให้เกิดพิษแบบเฉียบพลัน โดยไอปรอทจะสะสมอยู่ในเนื้อเยื่อปอด ไต และบางส่วนถูกดูดซึมเข้าไปในกระแสเลือด โดยเฉพาะ methyl mercury และ phenol mercury สามารถถูกดูดซึมได้ดีในบริเวณปอด หากคนที่เป็นโรคไตหรือไตไม่ทำงาน จะได้รับพิษรุนแรง เพราะมีการสะสมมาก จนทำให้เสียชีวิตได้ แต่หากไม่ถึงขั้นเสียชีวิต ปรอทที่สะสมในปอดและส่วนอื่นจะมีพิษต่อระบบประสาทส่วนกลางโดยตรง ทำให้เป็นอัมพาตได้อย่างรวดเร็ว
2. ทางผิวหนังหรือทางตา ไอระเหยของปรอทจะดูดซับได้ช้าๆผ่านผิวหนังในปริมาณที่สูง ทำให้เกิดการระคายเคืองต่อผิวหนังและดวงตาและอาจทำให้เกิดโรคผิวหนังอักเสบได้ การซึมผ่านผิวหนังในบางรายจะไม่แสดงอาการเป็นพิษ แต่บางรายที่มีภูมิไวต่อปรอทจะเกิดอาการแพ้ ผิวหนังเป็นผื่นแดง และรู้สึกแสบร้อนได้
3. ทางปาก โดยการรับประทาน อาจเกิดจากอุบัติเหตุปะปนกับอาหารและน้ำดื่ม จากนั้นจะถูกดูดซึมเข้ากระแสเลือด และสะสมที่อวัยวะภายใน ทำให้เกิดพิษเฉียบพลันได้ อาการที่ปรากฎ ได้แก่ แสบร้อนในลำคอ กระเพาะอาหาร และลำไส้ วิงเวียนศีรษะ อาเจียน เป็นต้น
เมื่อมนุษย์รับสารปรอทจากการหายใจ อากาศที่ปนเปื้อนจะเข้าสู่ปอดและเข้าสู่กระแสเลือด ไปตามอวัยวะต่างๆ โดยเฉพาะสมองและไต ปรอทในรูปของโลหะจะคงอยู่เป็นสัปดาห์หรือเดือนในอวัยวะทั่วไป แต่เมื่อปรอทเข้าสู่สมอง มันจะเปลี่ยนไปอยู่ในรูปของสารประกอบอนินทรีย์และคงอยู่ในสมองเป็นเวลานานเป็นปี ปรอทสามารถเข้าสู่ทารกในครรภ์ได้ เมื่อมารดาที่ตั้งครรภ์ได้รับสารปรอท โดยผ่านทางรก มีการศึกษาของ Lien และคณะ แสดงให้เห็นว่าเมื่อหญิงตั้งครรภ์ได้รับไอปรอทในอากาศ ปรอทสามารถแพร่ผ่านรกสู่ทารกในครรภ์ได้ เนื่องจากพบว่าเมื่อทารกคลอดออกมาพบปรอทในกระแสเลือด
ปริมาณที่ทำให้เกิดพิษจากการรายงาน คือ การได้ปรอท 100 กรัมครั้งเดียว หรือ 75 มก./วัน ต่อเนื่อง จะมีอันตรายถึงชีวิตได้ แต่ก็มีรายงานผู้ที่กินปรอทมากถึง 204 กรัม แต่มีอาการเพียงเล็กน้อย ปรอทจะถูกดูดซึมจากทางเดินอาหารได้น้อยกว่า 1% ดังนั้นโดยทั่วไปถือว่า การกินโลหะปรอทโดยไม่ได้ตั้งใจ เช่น ปรอทวัดไข้แตกขณะใช้งาน จะไม่มีผลเป็นพิษต่อร่างกาย การสูดดม (Inhalation) ไอปรอทเป็นทางเข้าหลักการเป็นพิษจากปรอท ปรอทถูกดูดซึมผ่านทางผิวหนังได้น้อยมากจนถือได้ว่าไม่ถูกดูดซึม ทางเข้าอื่น เข่น การฉีดเข้ากล้าม และการฉีดเข้าหลอดเลือดดำพบได้น้อย ไอปรอทจะถูก oxidized ในร่างกายเป็น Hg1+ และ Hg2+ และสามารถสะสมได้ในเนื้อเยื่อไขมันและไต สามารถขับออกทางปัสสาวะ โดยมีค่าครึ่งชีวิตเป็น 3-8 วันใน fast phase และเป็น 45 วันใน slow phase ปรอทจะจับกับ sulfhydryl (SH-) group ของเอนไซม์ แผ่นเยื่อของเซลล์ และโปรตีนในกระบวนการขนส่งในร่างกาย
การตรวจหา Mercury burden เป็นการยืนยันการสัมผัส (exposure) มากกว่าจะบอกความเป็นพิษ
Serum level: < 10 µg/L = normal > 20 µg/L = toxic (exposed)
Urine level: < 20 µg/L = normal > 50 µg/L = toxic (exposed)
การตรวจหาผลต่อสุขภาพ
การตรวจทางห้องปฏิบัติการทั่วไป เช่น CBC, renal function test, liver function test การตรวจพิเศษ เช่น Neurologic electrophysiologic study, Neurobehavioral/neuropsychiatric tests การวินิจฉัยทำได้โดยดูจากอาการและอาการแสดงเข้าได้กับการเป็นพิษ ร่วมกับการตรวจพบปรอทในร่างกายหรือสิ่งแวดล้อมในการทำงานหรือที่อยู่ การรักษาประกอบด้วยการรักษาตามอาการและอาการแสดง และการรักษาด้วยการ Chelation ซึ่งเป็นการเร่งการกำจัดปรอทออกจากร่างกาย โดยมีข้อบ่งชี้ในการใช้ คือ ผู้ป่วยที่ได้รับพิษเฉียบพลันและมีอาการรุนแรง และพิจารณาให้ในกรณีผู้ป่วยที่มีอาการของการเป็นพิษและสัมผัสปรอทอย่างต่อเนื่องเรื้อรัง ไม่ควรให้ในผู้ป่วยที่ไม่มีอาการแต่ตรวจพบระดับปรอทสูงในปัสสาวะหรือในเลือด Chelating agents ที่ใช้ได้แก่
- Dimercaprol I.M.
- meso-2,3-dimercaptosuccinic acid (DMSA) orally
- Sodium 2,3-dimercaptopropane-1-sulfonate (DMPS) orally or I.V.
การวัดปริมาณปรอทใน biomarker ต่างๆ
Biomarkers ในการตรวจสารปรอทในร่างกาย ได้แก่ ปัสสาวะ เส้นผม เล็บเท้า เป็นการวัดกรณีได้รับสะสมมานาน และเลือด กรณีรับสารปรอทแบบรุนแรงเฉียบพลัน โดยที่นิยมจะเป็นปัสสาวะและเลือด แต่ปัสสาวะถือว่าเป็น biomarker ที่น่าเชื่อถือที่สุด เพราะในเลือดมีสารปรอทในรูปอินทรีย์ที่เป็นส่วนประกอบในเม็ดเลือดแดง ส่วนการตรวจเส้นผมและเล็บเท้ายังไม่สามารถแยกแยะสารปรอทในรูปอินทรีย์และอนินทรีย์ได้
เทคนิคที่นิยมใช้ในการวิเคราะห์สารปรอท ได้แก่
- Cold vapor atomic absorption spectrometry
- Atomic absorption spectrometry
- Neutron activation analysis
ผลต่อสุขภาพ
การศึกษาในผู้ป่วยที่ได้รับปรอทเป็นจำนวนมากอย่างเฉียบพลัน การได้รับพิษเรื้อรัง และการศึกษาจากผู้ป่วยที่ได้รับปรอทเป็นจำนวนมากติดต่อกัน หรือ ได้ศึกษาต่อเนื่องจากการได้รับพิษเฉียบพลันเป็นจำนวนมาก ซึ่งร่างกายต้องใช้เวลานานในการขับออกได้หมด พบว่าพิษเฉียบพลัน (Acute exposure/poisoning) จากไอปรอท ประกอบด้วย Mucosal inflammation (HEENT, upper airway tract) Pneumonitis, pulmonary edema, renal injuries, confusion ส่วนพิษเรื้อรัง (Chronic exposure/poisoning) มีผลต่อสุขภาพในหลายระบบ ประกอบด้วย ผลต่อระบบทางเดินหายใจและปอด พบภาวะ Mercurialentis (brownish discoloration of lens), residual restrictive pulmonary diseases เป็นต้น
ผลต่อระบบประสาท
พิษสารปรอทมีผลมากที่ระบบประสาทส่วนกลาง เป็นปัญหาทางสุขภาพมากที่สุด มีอาการได้ตั้งแต่ สั่น พูดติดอ่าง เหนื่อย นอนไม่หลับ สูญเสียความทรงจำ หรือมีความผิดปกติทางอารมณ์ ได้แก่ หงุดหงิดง่าย หดหู่ ฉุนเฉียว กระวนกระวาย โกรธง่าย ยังรวมไปถึงความรุนแรงในการใช้ความคิด เก็บตัว ไม่ออกสังคม มีความคิดฆ่าตัวตาย และขาดความสามารถในการแก้ปัญหา ปรอทยังสามารถทำให้เกิดภาวะซึมเศร้าและความผิดปกติทางอารมณ์ โดยสัมพันธ์กับการลดลงของสารสื่อประสาท dopamine, serotonin, norepinephrine และ acetylcholinesterase
Acrodynia หรือ Pink disease
เป็นกลุ่มอาการที่แสดงผลการเป็นพิษจากสารปรอท มักพบในเด็กๆ อาการได้แก่ severe leg cramps ผิวหนังที่มือเท้าเป็นสีชมพูคล้ำ มีการเปื่อยลอกของผิวหนังที่มือและเท้า มีอาการเจ็บปวดปลายประสาท และมีอาการทางจิต สาเหตุของโรคได้รับการสงสัยว่าเป็นสารปรอทคลอไรด์ที่เรียกว่า Calomel
ผลกระทบต่อไต
ในมนุษย์และสัตว์เลี้ยงลูกด้วยนมอื่นๆ ไตเป็นเป้าหมายหลักที่มีการสะสมของปรอท แต่จะต้องได้รับในปริมาณมาก จึงจะเกิดอันตรายต่อไต ซึ่งภายในไตส่วนของ pars rectum ของ proximal tubule เป็นส่วนที่เปราะบางที่สุดของ nephron ที่จะได้รับพิษของปรอท มีการทดลองในไตของหนู พบว่าหลังจากได้รับ inorganic mercury ในปริมาณต่ำๆในช่องปากอย่างเฉียบพลัน เกิดการดูดซึมและการสะสมของปรอทในร่างกายจะเกิดขึ้นอย่างรวดเร็วถึง 50% (0.5 µmol/kg)
ผลกระทบต่อระบบหัวใจและหลอดเลือด
ถ้าสัมผัสกับปรอทที่ระดับความเป็นพิษ จะเกิดหัวใจเต้นเร็ว irregular pulse, chest pain, heart palpitation ปรอทมีผลต่อการทำงานของหัวใจโดยมีอิทธิพลต่อฮอร์โมนจากต่อมใต้สมอง ในสัตว์ทดลองที่มีการสัมผัสสารปรอท พบว่าเพิ่มแรงในการหดกล้ามเนื้อหัวใจทำให้ความดันโลหิตสูง โดยการสกัดกั้นแคลเซียมไอออนไว้ในเซลล์กล้ามเนื้อหัวใจ ยังพบว่าปรอทสามารถยับยั้งเอนไซม์ที่เยื่อหุ้มเซลล์กล้ามเนื้อในการผ่านเข้าออกของแคลเซียม มีรายงานว่าในคนที่บริโภคปลาบ่อยๆ มีความสัมพันธ์กับการมีความเสี่ยงเพิ่มขึ้นในการเกิด hypertension, myocardial infarction, coronary dysfunction และ atherosclerosis
ผลต่อระบบสืบพันธุ์
มีรายงานว่าสารปรอทอาจมีผลต่อสมรรถภาพการสืบพันธุ์ของทั้งเพศชายและเพศหญิง โดยอาจเกิดการคลอดผิดปกติ การเคลื่อนตัวและจำนวนอสุจิลดลง ความรู้สึกทางเพศลดลง เกิดการปฏิสนธิที่ไม่สมบูรณ์ ทำให้เกิดภาวะมีบุตรยาก พบความสัมพันธ์เชิงบวกระหว่างระดับ methyl mercury ที่เพิ่มขึ้นและอุบัติการณ์ของ malformation และการแท้ง การได้รับสารปรอทอาจเป็นสาเหตุที่ทำให้เกิดความผิดปกติของรอบเดือน
ด้านพันธุศาสตร์
การสัมผัสกับปรอท มีความเกี่ยวข้องกับการเกิด DNA hypomethylation คือลดการเติมหมู่ methyl ที่ DNA ของเนื้อเยื่อสมองในหมีขั้วโลก ทำให้เกิดการกลายพันธุ์ของยีน พบมีอาการของเด็กขาดสารอาหาร มีอาการวิกลจริตอย่างอ่อนๆ กรีดร้อง นัยน์ตาดำขยายกว้าง ลิ้นแห้ง แขนขาเคลื่อนไหวลำบาก มีการกระตุกตัวแข็ง แขนขาบิดงออย่างรุนแรง เพราะโรคนี้แสดงผลต่อระบบประสาทส่วนกลาง
ไม่มีหลักฐานที่แสดงว่าสารปรอทเป็นสารก่อมะเร็ง
ปัจจัยที่เกี่ยวข้องกับผลกระทบต่อสุขภาพและอาการของพิษจากปรอท
ปัจจัยที่กำหนดว่าจะเกิดผลกระทบต่อสุขภาพหรือไม่ ขึ้นกับชนิด รูปแบบของปรอทที่ได้รับ ปริมาณ อายุหรือระยะพัฒนาการของบุคคลที่สัมผัส ระยะเวลาของการสัมผัส เส้นทางการรับสัมผัส (สูดดม การกลืนกิน หรือทางผิวหนัง) มนุษย์ทุกคนสัมผัสกับปรอทระดับหนึ่ง คนส่วนใหญ่สัมผัสกับสารปรอทในระดับต่ำๆเป็นระยะเวลานาน เช่น บุคลากรทางทันตกรรม อย่างไรก็ตาม คนบางคนสัมผัสกับสารปรอทในปริมาณมาก แต่เกิดขึ้นในระยะเวลาสั้นๆ เช่น การได้รับสารปรอทจากอุบัติเหตุทางอุตสาหกรรม
อาการแสดงที่เกิดจากพิษปรอท ซึ่งสัมพันธ์ไปกับปริมาณที่สะสมในอวัยวะต่างๆ ที่ตรวจได้จากปัสสาวะ สามารถแสดงให้เข้าใจได้ง่ายๆด้วยการอ่านจากเทอร์โมมิเตอร์ ดังแสดงในรูปที่ 1

รูปที่ 1 อาการพิษของสารปรอทแบ่งตามระดับความเข้มข้นของปรอทในปัสสาะ (คัดลอกจาก แนวปฏิบัติทางทันตกรรมในการใช้ปรอทอย่างปลอดภัย สถาบันทันตกรรม กรมการแพทย์ กระทรวงสาธารณสุข)
- ระดับต้น 0-25 ไมโครกรัม ต่อ กรัมครีเอตินีน ในช่วงนี้มักไม่เกิดอาการแสดงใดๆกับร่างกาย แต่ในคนที่อุดฟันด้วยอะมัลกัมหลายซี่ สามารถพบปรอทในปัสสาวะได้ถึง 4 ไมโครกรัม ต่อ กรัมครีเอตินีน
- ระดับที่ 2 ตั้งแต่ 25-100 ไมโครกรัม ต่อ กรัมครีเอตินีน จะไม่ปรากฏการเปลี่ยนแปลงของอาการอย่างชัดเจน อาจพบเพียงการตอบสนองการทดสอบการเหนี่ยวนำสัญญาณสมองต่ำลงกว่าปกติ คลื่นสมองทำงานช้าลง และทักษะการพูดผิดปกติไป
- ระดับที่ 3 ตั้งแต่ 100-500 ไมโครกรัม ต่อ กรัมครีเอตินีน เป็นระดับที่ทำให้มีอาการตั้งแต่น้อยจนถึงปานกลาง ได้แก่ กระวนกระวาย หดหู่ สูญเสียความทรงจำ สั่นเล็กน้อย มีอาการทางประสาท และไตเริ่มทำงานผิดปกติ
- ระดับอาการชัดเจน ตั้งแต่ 500-1000 ไมโครกรัม ต่อ กรัมครีเอตินีน อาการที่พบคือ ไตอักเสบ เหงือกบวม สั่นมาก และอาการทางระบบประสาท
ปัจจุบันด้วยข้อมูลเกี่ยวกับการเป็นพิษจากปรอท ทำให้มีแนวโน้มการลดการใช้ปรอท การใช้วิธีการป้องกันตนเอง การเปลี่ยนแปลงขบวนการทางอุตสาหกรรม การจัดการ และการกำจัดปรอท อย่างไรก็ตามในการลดการใช้ปรอท จะต้องมีการศึกษาถึงผลดีผลเสียของการใช้สารอื่น หรือ วิธีการอื่นที่มาทดแทนด้วยอะมัลกัม (Amalgam) คืออะไร
อะมัลกัมในทางทันตกรรม (dental amalgam) เป็นวัสดุบูรณะที่ใช้มาเป็นเวลานานกว่า 150 ปี อะมัลกัมเป็นวัสดุบูรณะที่เกิดจากการผสมโลหะผสมอัลลอย เข้ากับปรอท อะมัลกัมจึงเป็นสารประกอบของโลหะหลายชนิด เช่น เงิน ดีบุก ทองแดง เป็นต้น เมื่อผสมกับปรอท ทำให้เกิดปฏิกิริยาก่อตัวของวัสดุ อะมัลกัมเป็นวัสดุที่ใช้งานได้ง่ายและมีคุณสมบัติที่ดีในแง่ของความแข็งแรง ทนต่อแรงกดและแรงดึงได้เป็นอย่างดีเมื่อเทียบกับวัสดุบูรณะทางตรงอื่นๆ อะมัลกัมมีสีไม่เหมือนฟัน และไม่สามารถยึดติดกับโครงสร้างฟันได้เหมือนวัสดุบูรณะสีเหมือนฟันชนิดอื่น แต่คุณสมบัติการกร่อน (corrosion) ของอะมัลกัมทำให้เกิดออกไซด์ซึ่งช่วยเสริมความแนบกับผนังโพรงฟันและป้องกันการผุซ้ำได้เป็นอย่างดี อย่างไรก็ตาม อะมัลกัมมีคุณสมบัติในการเปลี่ยนรูปร่างเมื่อผ่านการใช้งานไปเป็นเวลานานที่เรียกว่า การคืบ (creep) ส่งผลให้วัสดุไม่มีผลเสียต่อฟันมาก (forgiving) เพราะเปลี่ยนรูปร่างได้บ้างตามแรงการบดเคี้ยวที่กระทบลงมา อะมัลกัมจึงยังเป็นตัวเลือกที่ดีในการบูรณะฟันในหลายๆกรณี
หลายปีที่ผ่านมาอะมัลกัมถูกลดการใช้งานลงเพราะความนิยมเรื่องวัสดุที่ให้ความสวยงามมีมากขึ้น ประกอบกับการใช้สารยึดติดร่วมกับวัสดุที่มีสีคล้ายฟันเหล่านั้นทำให้ไม่ต้องกรอฟันมาก (Minimal Intervention Approach) ทันตแพทย์จึงลดการใช้อะมัลกัมลง อย่างไรก็ตาม มีการกล่าวถึงความกังวลเรื่องความปลอดภัยจากปรอทที่เป็นส่วนผสมหลักในอะมัลกัม Bayne และคณะในปี 2013 กล่าวว่าอัตราส่วนของปรอทจากการรักษาทางทันตกรรมนั้นไม่เกินร้อยละ 5 ของปริมาณปรอททั้งหมดที่อยู่ในสิ่งแวดล้อม ในปัจจุบันการผสมอะมัลกัมใช้รูปแบบแคปซูลสำเร็จรูปที่มีการตวงวัดอัตราส่วนของอะมัลกัมอัลลอยและปรอทมาเป็นอัตราส่วน 1:1 โดยน้ำหนัก รวมทั้งผสมในเวลาที่กำหนด จะช่วยให้ปรอทถูกใช้ไปในปฏิกิริยาเกือบหมดหรือหมด ลดปัญหาปริมาณปรอทส่วนเกินได้ ขั้นตอนการกดอัดวัสดุให้แนบกับผนังโพรงฟัน (condensation) เป็นอีกขั้นตอนที่ทำให้ปรอทลอยขึ้นสู่ผิวของอะมัลกัม และถูกกำจัดออกในขั้นตอนการแต่งรูปร่าง ปรอทที่อยู่ในเฟสแกมม่า 1 (gamma 1) มักอยู่ในรูปที่เสถียร จะถูกปลดปล่อยออกมาได้เมื่อมีการกรอแต่งหรือขัดด้วยความร้อนสูง ส่วนปรอทในเฟสแกมม่า 2 (gamma 2) จะไม่เสถียรและกลายเป็นออกไซด์ที่ทำให้เกิดการกร่อนและเกิดเป็นคราบสีดำบนผิวอะมัลกัม สามารถขัดออกได้โดยไม่เป็นอันตราย อะมัลกัมที่มีใช้ในปัจจุบันมักไม่พบแกมม่า 2 หรือพบน้อยมาก เพราะมีการปรับส่วนผสมให้มีทองแดงมากขึ้นทำให้ลดการเกิดแกมม่า 2 ลง
ในคนทั่วไปมักได้รับสารปรอทจากการรับประทานอาหารทะเลโดยเฉพาะอย่างยิ่งปลา (ซึ่งมักได้รับ methyl mercury และพบว่ามี inorganic mercury ร่วมด้วยในปริมาณต่ำ) และจากวัสดุบูรณะฟันอะมัลกัม (ในรูปของไอปรอท และ inorganic mercury) ไม่ว่าจะเป็นปรอทในรูปแบบใด เมื่อมีปริมาณสูงพอ มีความเป็นพิษต่อมนุษย์และสัตว์ทดลองทั้งสิ้น กลไกและความรุนแรงต่างกันขึ้นกับรูปแบบที่ได้รับ ปรอทจากอะมัลกัมมักถูกปล่อยสู่สิ่งแวดล้อมในรูปของไอระเหย ไอออน หรืออนุภาคขนาดเล็กที่สามารถเข้าสู่ร่างกายได้โดยการหายใจเข้าไป หรือผ่านระบบทางเดินอาหารได้ จากข้อกำหนดขององค์การอนามัยโลก (WHO) ในปี 2007 ได้กำหนดค่าปริมาณปรอทที่ร่างกายสามารถทนได้เมื่อต้องหายใจสูดไอระเหยระยะยาวที่ 0.2 ไมโครกรัมต่อตารางเมตร และปริมาณปรอทที่ร่างกายได้รับจากการรับประทานสูงสุดที่ร่างกายทนได้ คือ 2 ไมโครกรัมต่อน้ำหนักตัว 1 กิโลกรัม นอกจากนี้ ปริมาณปรอทที่ถูกขับออกมากับปัสสาวะไม่ควรเกิน 30 ไมโครกรัมต่อปริมาณครีเอตินิน 1 กรัมในปัสสาวะ (IPCS (2003) Concise International Chemical Assessment Document 50: Elemental mercury and inorganic mercury compounds: human health aspects. Geneva, World Health Organization, International Programme on Chemical Safety) จากการศึกษาของ Mackert และ Berglund ในปี 1997 พบว่าต้องเคี้ยวบนผิวอะมัลกัม 450 ถึง 530 ด้าน จึงจะได้ปรอทเท่าปริมาณดังกล่าวในครีเอตินิน 1 กรัมในปัสสาวะ นอกจากนี้ยังพบอีกว่า โดยปกติปริมาณปรอทที่มาจากการบดเคี้ยวบนผิวอะมัลกัมอยู่ในระดับ 1-3 ไมโครกรัมต่อวัน ซึ่งเป็นระดับที่น้อยกว่าปริมาณปรอทจากอาหารและสิ่งแวดล้อมอย่างมาก (Mackert and Berglund, 1997) Berglund และ Morlin ในปี 1997 ยังพบอีกว่าปริมาณปรอทในปัสสาวะและในพลาสมาจะเพิ่มขึ้นในผู้ป่วยที่ได้รับการรื้ออะมัลกัมออกโดยไม่ใส่แผ่นยางกั้นน้ำลาย โดยปริมาณปรอททั้งในปัสสาวะและในพลาสมาลดลงสู่ค่าที่น้อยกว่าหรือเท่ากับก่อนรื้อวัสดุออกในหนึ่งปีถัดมาที่มีการตรวจติดตามผู้ป่วย (Berglund and Morlin, 1997) นอกจากการศึกษาถึงระดับปริมาณปรอทในร่างกายผู้ป่วยที่มีอะมัลกัม ยังมีการศึกษาถึงความสัมพันธ์ของอะมัลกัมกับโรคทางระบบของผู้ป่วยด้วย ในการศึกษาของ Ahlqwist และคณะ ในปี 1999 ทำการศึกษาปริมาณปรอทที่อยู่ในซีรั่มของผู้ป่วยที่ได้รับการบูรณะด้วยอะมัลกัมโดยติดตามผลต่อเนื่อง 25 ปี พบความสัมพันธ์ของปริมาณปรอทในซีรั่มกับจำนวนอะมัลกัมในช่องปาก อย่างไรก็ตาม ไม่พบความสัมพันธ์ของปริมาณปรอทดังกล่าวกับโรคทางระบบของผู้ป่วยรายนั้นๆทั้งเบาหวาน หัวใจ และโรคไต (Ahlqwist et al., 1999) จากการศึกษาของ Factor-Litvak และคณะในปี 2003 ไม่พบความสัมพันธ์ของปริมาณอะมัลกัมในปากกับการทำงานของระบบประสาทจิตวิทยา (neuropsychologic function) และพบว่าถึงแม้จะมีปริมาณด้านของฟันที่บูรณะด้วยอะมัลกัมเฉลี่ยมากกว่า 15 ด้าน ปริมาณปรอทที่ออกมากับปัสสาวะนั้นก็ไม่เกิน 5 ไมโครกรัมต่อปริมาณครีเอตินิน 1 กรัมในปัสสาวะ (Factor-Litvak et al., 2003)
นอกจากปรอทในอะมัลกัมแล้ว โลหะหนักอื่นๆทั้งเงิน ดีบุก ทองแดง และสังกะสีนั้น มีความเป็นพิษเช่นกันหากได้รับในปริมาณที่มากในคราวเดียว ดังนี้ โลหะเงินนั้นมีรายงานค่อนข้างน้อย ปกติร่างกายผู้ใหญ่มักจะได้รับโลหะเงินจากอาหารประมาณ 70-90 ไมโครกรัมต่อวัน โลหะเงินในปริมาณมากอาจทำให้เกิดการระคายเคืองที่ผิวหนังหรือทางเดินอาหารได้ และอาจทำให้เกิดเนื้อเยื่อสีม่วงดำจากการสะสมของสารประกอบซิลเวอร์ซัลไฟด์ในเนื้อเยื่อ (Drake and Hazelwood, 2005) ส่วนดีบุกนั้น หากได้รับในปริมาณมากจากอากาศที่ปนเปื้อนจะทำให้เกิดภาวะฝุ่นจับปอด (pneumoconiosis) หากรับประทานอาหารที่ปนเปื้อนดีบุกจะทำให้เกิดอาการคลื่นไส้ อาเจียน และท้องเสีย จาการศึกษาในมนุษย์ ไม่พบรายงานผลกระทบของดีบุกต่อการสืบพันธุ์และการเจริญเติบโต จากการศึกษาในสัตว์ พบว่าปริมาณดีบุกที่มากเกินไปในอาหารจะส่งผลกระทบต่อระดับของแร่ธาตุอื่นๆในร่างกายและทำให้เกิดภาวะโลหิตจางได้ (Klaasen, 2001) ทองแดงเป็นธาตุที่สำคัญต่อการทำงานของเอนไซม์และโปรตีนบางส่วนในร่างกายมนุษย์ หากขาดธาตุทองแดงจะมีผลให้เกิดภาวะโลหิตจางได้ ปกติแล้วร่างกายควรได้รับทองแดงไม่เกิน 0.5 มิลลิกรัมต่อน้ำหนักตัว 1 กิโลกรัมต่อวัน ทองแดงจากอะมัลกัมอาจถูกดูดซึมได้ที่กระเพาะอาหารและลำไส้เล็กและขับออกโดยตับไปทางอุจจาระ ปริมาณทองแดงที่มากเกินไปนั้นทำให้เกิดผลเสียต่ออวัยวะหลายระบบ ทั้งตับ ไต ระบบเลือด ภูมิคุ้มกัน และพัฒนาการ นอกจากจะทำให้มีอาการคลื่นไส้ อาเจียนเมื่อได้รับปริมาณสูงกว่า 100 เท่าของระดับทองแดงที่ควรได้รับในแต่ละวันอย่างเฉียบพลัน ทองแดงยังเป็นพิษต่อตับ ทำให้เกิดตับอักเสบและมีภาวะเนื้อตาย เกิดเป็นตับวายได้ในที่สุด (Klaassen, 2001) สังกะสีเป็นหนึ่งในธาตุอาหารที่สำคัญต่อร่างกาย หากได้รับไม่เพียงพอจะทำให้เกิดอาการผิวหนังอักเสบ การเจริญเติบโตถดถอย การหายของแผลช้าลง ลดภาวะการสืบพันธุ์ รวมไปถึงเป็นปัจจัยร่วมให้เกิดภาวะซึมเศร้าได้ ปริมาณสังกะสีที่มากเกินไปในปริมาณ 140 – 560 มิลลิกรัมอย่างเฉียบพลันสามารถทำให้เกิดการอาเจียน ตะคริวในช่องท้อง และท้องเสียได้ รายงานการศึกษาในสัตว์ทดลองพบว่า หากได้รับปริมาณสูงกว่า 200 มิลลิกรัมต่อน้ำหนักตัว 1 กิโลกรัมต่อวันเป็นเวลานาน จะมีผลต่อระบบพัฒนาการและระบบสืบพันธุ์ได้ (Klaasen, 2001) โลหะอื่นๆที่เป็นองค์ประกอบในอะมัลกัมมีทั้งที่จำเป็นต่อร่างกายและเป็นพิษต่อร่างกายหากได้รับปริมาณสูงมาก อย่างไรก็ตาม ยังไม่มีหลักฐานสรุปชัดเจนว่าโลหะต่างๆเหล่านี้ในอะมัลกัมมีผลเสียต่อร่างกายในระยะยาว นอกจากผู้ป่วยมีอาการแพ้ต่อโลหะนั้นๆ
อนุสัญญามินามาตะ (Minamata Convention)
อนุสัญญามินามาตะว่าด้วยการใช้สารปรอท (2013) คือสนธิสัญญาระหว่างประเทศที่กำหนดออกมาเพื่อปกป้องสุขภาพมนุษย์และสิ่งแวดล้อมจากการปลดปล่อยสารปรอท ทั้งจากทางธรรมชาติและจากการใช้ผลิตภัณฑ์ที่มีปรอทเป็นองค์ประกอบ รวมถึงวัสดุบูรณะฟันชนิดอะมัลกัม ซึ่งมีปรอทเป็นส่วนประกอบร้อยละ 50 โดยประมาณ องค์การอนามัยโลก (WHO) จึงเรียกร้องให้ค่อยๆลดการใช้ (phase down) อะมัลกัมลง โดยกำหนดอยู่ในภาคผนวก Annex A Part II: Products subject to Article 4, paragraph 3 ของอนุสัญญามินามาตะ
มีการกำหนด 9 มาตรการในการลดการใช้อะมัลกัม ได้แก่
(i) กำหนดเป็นวัตถุประสงค์ของชาติในการเน้นมาตรการการป้องกันฟันผุ สนับสนุนการสร้างทันตสุขภาพที่ดีเพื่อลดอัตราการบูรณะฟันลง
(ii) กำหนดเป็นเป้าประสงค์แห่งชาติในการลดการใช้
(iii) สนับสนุนการใช้วัสดุทางเลือกที่มีประสิทธิผลทั้งในด้านค่าใช้จ่ายและอายุการใช้งาน
(iv) สนับสนุนการศึกษาวิจัยวัสดุบูรณะที่ปราศจากสารปรอท
(v) ส่งเสริมให้สถาบัน สมาคม ชมรมทางวิชาชีพ มีการเรียนการสอน การฝึกอบรม การใช้งานวัสดุทางเลือกที่ปราศจากปรอท
(vi) ไม่สนับสนุนระบการประกันทันตสุขภาพที่ยังจ่ายค่าบูรณะฟันด้วยอะมัลกัม
(vii) ส่งเสริมระบบการประกันที่ใช้วัสดุทางเลือกที่มีคุณภาพในการบูรณะฟันแทนการใช้อะมัลกัม
(viii) ใช้อะมัลกัมในรูปแบบแคปซูลเท่านั้น
(ix) สนับสนุนการดูแลสถานประกอบการ คลินิก โรงพยาบาลให้มีการจัดการใช้สารปรอทและการปลดปล่อยลงสู่แหล่งของสียอย่างถูกต้องปลอดภัย
ประเทศไทยได้ลงนามเข้าร่วมเป็นภาคีสมาชิกของอนุสัญญามินามาตะ ตามมติคณะรัฐมนตรี โดยมีผลบังคับตั้งแต่วันที่ 20 กันยายน พ.ศ.2560
ผลกระทบของอะมัลกัมที่มีต่อทันตบุคคลากร (Exposure to mercury and adverse effects of dental amalgam in dental personnel)
ความเสี่ยงจากการได้รับสารปรอทจากสายอาชีพ
อาชีพที่มีความเสี่ยงที่จะได้รับสารปรอท ได้แก่ ผู้ผลิตอุปกรณ์ไฟฟ้า หรือชิ้นส่วนยานยนต์ โรงงานแปรรูปเคมี การแปรรูปโลหะ วัสดุก่อสร้าง (เช่น สวิทช์ไฟฟ้า และเครื่องวัดอุณหภูมิ) และวิชาชีพทางการแพทย์ เช่นแพทย์ ทันตแพทย์และบุคลากรทางทันตกรรม บุคลากรที่เกี่ยวกับการบริการด้านสุขภาพอื่นๆ บุคลากรทางทันตกรรมที่ทำงานเกี่ยวข้องกับอะมัลกัมจะสัมผัสกับไอปรอทเป็นประจำซึ่งสะสมอยู่ในร่างกายในระดับที่สูงกว่าอาชีพอื่น ๆ โดยได้รับสารปรอทจากอะมัลกัมในขั้นตอนต่างๆ ทั้งการจัดเก็บ จัดเตรียม การตกแต่งและการขัดผิว การรื้อวัสดุอุดฟันเก่า และการทำความสะอาดพื้นที่ทำงานและเครื่องมือ มีการศึกษาค่าเฉลี่ยความเข้มข้นของปรอทจากเครื่องวัดการหายใจส่วนบุคคลของทันตแพทย์พบว่ามีค่าเฉลี่ย 29.2 µg/ m³ ซึ่งสูงกว่ามาตรฐานการได้รับสารในการทำงานที่กำหนดไว้ที่ 25 µg/m³ ในทำนองเดียวกันกับระดับปรอทในปัสสาวะของทันตแพทย์ พบว่าสูงกว่ากลุ่มควบคุม 3-4 เท่า โดยในทันตแพทย์วัดได้ 3.1 nmol Hg/nmol creatinine ส่วนกลุ่มควบคุมวัดได้ 0.99 nmol Hg/nmol creatinine
ค่าขีดจำกัดการรับสัมผัสสารเคมีในที่ทำงาน (Workplace Exposure Limits)
ระดับของไอปรอทในสถานที่ทำงาน กำหนดจากหน่วยงานต่างๆ มีดังนี้
- Occupational Safety and Health Administration: OSHA เป็นหน่วยงานเกี่ยวกับมาตรฐานความปลอดภัยและอาชีวอนามัยของสหรัฐอเมริกา จะกำหนดค่าที่ใช้ทางกฎหมาย กำหนดค่า permissible exposure limit (PEL) หรือปริมาณของสารเคมีที่ผู้ปฏิบัติงานจะสัมผัสกับสารเคมีได้อย่างปลอดภัย ว่าไม่ควรเกิน 0.1 mg/m³ โดยทำงานวันละไม่เกิน 8 ชั่วโมง สัปดาห์ละ 5 วัน หรือสัปดาห์ละ 40 ชั่วโมง
- National Institute for Occupational Safety and Health: NIOSH เป็นหน่วยงานเกี่ยวกับมาตรฐานความปลอดภัยและอาชีวอนามัยอีกหน่วยงานหนึ่ง แนะนำค่า recommended exposure limit (REL) หรือระดับไอปรอทในที่ทำงานไม่เกิน 0.05 mg/m³ ทำงานวันละไม่เกิน 8 ชั่วโมง หรือสัปดาห์ละ 40 ชั่วโมง ซึ่งค่าที่กำหนดนี้บางรายงานเห็นว่าสูงไป บางประเทศจึงกำหนดให้ต่ำลง
- American Conference of Governmental Industrial Hygienists: ACGIH เป็นองค์กรนักสุขศาสตร์อุตสาหกรรมภาครัฐแห่งอเมริกา คล้ายๆกับกรมควบคุมมลพิษ แนะนำค่า threshold limit value (TLV) กำหนดให้สูงไม่เกิน 0.025 mg/m³ ทำงานวันละไม่เกิน 8 ชั่วโมง
ค่าทั้ง 3 มีความหมายที่แตกต่างกัน โดยเฉพาะค่าของ OSHA จะเป็นค่าที่บังคับใช้ตามกฎหมาย จึงมีค่าเกินนี้ไม่ได้ ส่วนค่าอื่นๆเป็นเพียงมาตรฐานเพื่อความปลอดภัยสำหรับใช้เป็นแนวปฏิบัติและเพื่อแก้ไข
การวัดปริมาณปรอทในปัสสาวะ
การศึกษาในสก็อตแลนด์ พบว่าทันตแพทย์มีระดับปรอทในปัสสาวะเฉลี่ยสูงกว่ากลุ่มควบคุม 4 เท่า ในประเทศตุรกีพบว่าระดับปรอทในปัสสาวะของผู้ช่วยทันตแพทย์สูงกว่าทันตแพทย์ ในอิหร่านและอียิปต์พบระดับปรอทในปัสสาวะของบุคลากรทางทันตกรรมสูงกว่ากลุ่มควบคุม ในประเทศนอร์เวย์ห้ามใช้อะมัลกัมเป็นวัสดุบูรณะตั้งแต่ปี ค.ศ. 2008 จากปี ค.ศ. 1995-2002 พบว่าการใช้อะมัลกัมเป็นวัสดุอุดในฟันน้ำนมลดลง 95% และลดลง 85% ในฟันแท้ของเด็กและวัยรุ่น มีการศึกษาแสดงค่าเฉลี่ยปริมาณปรอทในปัสสาวะของทันตแพทย์ในปี คศ. 1960 และ 1990 เท่ากับ 240 และ 22 nmol/l ตามลำดับ ส่วนของผู้ช่วยทันตแพทย์เท่ากับ 160 และ 21 nmol/l ตามลำดับ ซึ่งหน่วยงานด้านสิ่งแวดล้อมในประเทศนอร์เวย์ได้กำหนดปริมาณปรอทในปัสสาวะไม่ควรเกิน 200 nmol/l และพบมีการลดระดับปรอทในปัสสาวะ จากปี ค.ศ. 1960 ถึง 1990 ในทันตแพทย์ แต่พบว่าระดับปรอทในปัสสาวะของผู้ช่วยทันตแพทย์สูงกว่าทันตแพทย์
การวัดปริมาณปรอทในเลือด
การศึกษาในประเทศอียิปต์ พบระดับปรอทในเลือดของบุคลากรทางทันตกรรมสูงกว่ากลุ่มควบคุม 1.5 เท่า ในประเทศตุรกีพบระดับปรอทในพลาสมาของบุคลากรทางทันตกรรมสูงกว่ากลุ่มควบคุมอย่างมีนัยสำคัญทางสถิติ
การวัดปริมาณปรอทในเล็บเท้า
การศึกษาของ Joshi และคณะ พบระดับปรอทในเล็บเท้าของทันตแพทย์ทั่วไปมีค่าเท่ากับ 0.94 ppm สูงกว่ากลุ่มควบคุมที่มีค่าเท่ากับ 0.45 ppm ถึง 2 เท่า และสูงกว่าทันตแพทย์เฉพาะทาง 60% ที่มีค่าเท่ากับ 0.59
การวัดปริมาณปรอทในเส้นผม
จากการศึกษาในประเทศเลบานอน พบว่าร้อยละ 25.25 ของทันตแพทย์มีระดับปรอทในเส้นผมมากกว่า 5 ppm ขณะที่ 7.07% มีระดับมากกว่า 10 ppm การศึกษาของ Talamanca ที่วัดปริมาณปรอทในเส้นผมของผู้ช่วยทันตแพทย์ พบความสัมพันธ์เชิงบวกระหว่างระดับ methyl mercury ที่เพิ่มขึ้น และอุบัติการณ์การเกิด malformation และการแท้งของทารก และพบว่าการได้รับสารปรอทเป็นสาเหตุที่ทำให้เกิดความผิดปกติของรอบเดือน
จากหลายการศึกษา มีการสรุปได้ว่าในทันตบุคคลากรมีระดับ biomarkers สูงขึ้น ทั้งนี้ขึ้นกับชั่วโมงการทำงานที่ยาว ลักษณะของสถานที่ทำงาน และมาตรฐานด้านความปลอดภัยและสุขอนามัยที่ต่ำ
การศึกษาผลกระทบด้านสุขภาพจากการได้รับสารปรอทจากการทำงานของบุคลากรทางทันตกรรม
มีการศึกษาพบว่ามีความเกี่ยวข้องกันระหว่างจำนวนของการอุดฟันอะมัลกัมต่อวันกับความผิดปกติของระบบประสาท และกล้ามเนื้อ พบได้บ่อยในทันตแพทย์มากกว่ากลุ่มควบคุม อย่างไรก็ตาม อาจมีปัจจัยกวนจากการที่ทันตแพทย์สัมผัสสารเคมีอันตรายอื่นๆได้ ในการศึกษาย้อนหลังของเดนมาร์ก ได้พบความสัมพันธ์อย่างมีนัยสำคัญทางสถิติระหว่างประสบการณ์การทำงานและอาการ สังเกตเห็นว่าทันตแพทย์มีความผิดปกติของไตมากกว่ากลุ่มควบคุม พบว่าความเข้มข้นของปรอทในปัสสาวะมีความสัมพันธ์กับหน่วยความจำที่มีประสิทธิภาพการทำงานลดลง Sletvold และคณะ รายงานว่ามีความสัมพันธ์กันอย่างมีนัยสำคัญทางสถิติระหว่างค่าปรอทในปัสสาวะและความจำระยะยาวของภาพ เมื่อประเมินจากอุปกรณ์/เครื่องมือที่ใช้ในการเตรียม จัดเก็บ การบูรณะ และการรื้ออะมัลกัม ในทุกการศึกษาพบว่าระดับปรอทในเลือดเพิ่มขึ้น เมื่อมาตรฐานด้านความปลอดภัยและสุขอนามัยต่ำลง มีการศึกษาหนึ่งที่ได้ตรวจสอบพฤติกรรมการปฏิบัติงานของบุคลากรทางทันตกรรม พบว่ามีระดับปรอทในปัสสาวะสูง คือไม่ได้ใส่ face shield และถุงมือเมื่อใช้อะมัลกัม อีกทั้งพบว่าการไม่มีระบบระบายอากาศที่เหมาะสม และทำความสะอาดเศษอะมัลกัมไม่ถูกต้อง ส่งผลให้ระดับปรอทในร่างกายสูงขึ้นได้ จึงอาจกล่าวได้ว่าสภาพแวดล้อมในการทำงานมีบทบาทสำคัญในการได้รับสารปรอทของบุคลากรทางทันตกรรม Svendsen และคณะกล่าวว่าการลดลงของปรอทในช่วงหลายปีที่ผ่านมา เนื่องจากการปรับปรุงการปฏิบัติด้านสุขอนามัย วิธีการเตรียมอะมัลกัมที่ดีขึ้น และการพัฒนา amalgam alloy ที่ดีขึ้น Joshi และคณะได้พบความสัมพันธ์ระหว่างความถี่ของการบริโภคปลา และการเพิ่มขี้นของระดับปรอทในเล็บเท้าในทันตแพทย์ทั่วไป ทันตแพทย์เฉพาะทาง และกลุ่มควบคุม
ตัวอย่างการศึกษาในประเทศไทย
1. การศึกษาในทันตบุคคลากรที่จังหวัดนครศรีธรรมราช
เป็นการศึกษาที่วัดปริมาณปรอทในอากาศที่คลินิกทันตกรรม และระดับความเข้มข้นของปรอทในปัสสาวะ ประกอบกับการศึกษาถึงปัจจัยอื่นๆ เช่น ข้อมูลประชากรทั่วไป ตำแหน่งงาน สภาพแวดล้อมการทำงาน และพฤติกรรมสุขศาสตร์ รวมทั้งชนิดของงานที่ทำ การศึกษานี้เป็น case-control study ที่ศึกษาในผู้ที่มีโอกาสได้รับปรอท 124 คน เปรียบเทียบกับผู้ที่ไม่ได้รับปรอท 124 คน ผู้เข้าร่วมวิจัยได้ตอบแบบสอบถามเกี่ยวกับข้อมูลส่วนตัวทั่วไป พฤติกรรมการบริโภคอาหาร รูปแบบอาชีพการทำงาน สภาพแวดล้อมในการทำงาน และสุขอนามัยส่วนบุคคล จากนั้นทำการเก็บตัวอย่างปัสสาวะเพื่อนำไปหาปริมาณปรอท วิเคราะห์ด้วยวิธี cold-vapor atomic absorption spectrometer mercury analyzer และเก็บตัวอย่างอากาศในบริเวณต่างๆภายในคลินิกทันตกรรม ได้แก่ บริเวณเก้าอี้ทำฟัน บริเวณที่เก็บเศษขยะอะมัลกัม และบริเวณพื้นผิวที่เตรียมอะมัลกัม เพื่อหาความเข้มข้นของไอปรอทในอากาศ
ผลการศึกษาพบว่า 17.6% ของตัวอย่างอากาศมีค่าสูงกว่าเกณฑ์ที่กำหนด (ในการศึกษานี้ใช้เกณฑ์ของ ACGIH แนะนำค่า TLV กำหนดให้สูงไม่เกิน 0.025 mg/m³ ทำงานวันละไม่เกิน 8 ชั่วโมง) ปัจจัยทำนายที่สำคัญของระดับปรอทในปัสสาวะ ได้แก่ การบริโภคอาหาร (ปลาหรืออาหารทะเล) ระยะเวลาของการทำงาน (ปี) ตำแหน่งบริเวณที่ทำงาน อุปกรณ์ป้องกันส่วนบุคคลที่ใช้ (PPE) และพฤติกรรมสุขอนามัยส่วนบุคคล พบความสัมพันธ์อย่างมีนัยสำคัญทางสถิติระหว่างปริมาณปรอทในปัสสาวะกับบริเวณที่เก็บปรอท และระหว่างระดับปรอทในปัสสาวะกับปรอทในอากาศในตัวอย่างส่วนบุคคล
สรุปได้ว่า แนะนำให้ปรับปรุงบริเวณสถานที่ทำงาน การฝึกอบรมอาชีวอนามัย และการใช้อุปกรณ์ป้องกันส่วนบุคคล เพื่อช่วยลดการสัมผัสสารปรอท
2. ปริมาณปรอทในปัสสาวะของทันตบุคลากรในจังหวัดนครปฐม
เป็นการศึกษาที่วัดปริมาณปรอทในปัสสาวะของทันตบุคลากร ในจังหวัดนครปฐม ระหว่างเดือน กุมภาพันธ์ –มีนาคม 2540 โดยมีวัตถุประสงค์คือเพื่อศึกษาการสัมผัสปรอทในกลุ่มทันตบุคลากร โดยการวิเคราะห์ปริมาณปรอทในปัสสาวะ ซึ่งเป็นการวัดค่าทางชีวภาพอย่างหนึ่งที่มีความสัมพันธ์อย่างใกล้ชิดกับปริมาณไอปรอทในอากาศที่หายใจเข้าไป โดยเปรียบเทียบปริมาณปรอทในปัสสาวะของทันตบุคลากรกับบุคคลทั่วไป และเปรียบเทียบของทันตบุคลากรที่รับราชการกับไม่ได้รับราชการ โดยกลุ่มทันตบุคลากร 62 คน แบ่งเป็นกลุ่มที่รับราชการ 23 คน (ทันตแพทย์ 8 คน และ ผู้ช่วยทันตแพทย์ 15 คน) และกลุ่มที่ไม่ได้รับราชการ 39 คน (ทันตแพทย์ 12 คน และ ผู้ช่วยทันตแพทย์ 27 คน) กลุ่มควบคุมคือ ประชากรทั่วไปที่ไม่ได้สัมผัสปรอทจากการประกอบอาชีพ 21 คน ทำการเก็บตัวอย่างปัสสาวะ 50 มิลลิลิตร วิเคราะห์หาปริมาณสารปรอทโดยใช้เครื่อง Flameless Atomic Absorption Spectrophotometer ซึ่งมีความไวสูงและสามารถวัดสารในปริมาณน้อยได้ ใช้สถิติ Mann-Whitney U-test เปรียบเทียบค่าเฉลี่ยปริมาณปรอทในปัสสาวะระหว่าง 2 กลุ่ม และใช้ Kruskal-Wallis 1-Way ANOVA ทดสอบค่าเฉลี่ยของปริมาณปรอทในปัสสาวะที่มากกว่า 2 กลุ่ม
ผลการศึกษาพบว่ากลุ่มผู้ช่วยทันตแพทย์ที่ไม่ได้รับราชการ มีระดับปรอทในปัสสาวะเฉลี่ยมากที่สุดคือ 61.56 µg/L รองลงมาเป็นกลุ่มทันตแพทย์ที่ไม่ได้รับราชการ 42.82 µg/L กลุ่มผู้ช่วยทันตแพทย์และทันตแพทย์ที่รับราชการ พบค่าเฉลี่ยปรอทในปัสสาวะใกล้เคียงกันคือ 15.24 และ 12.79 µg/L ตามลำดับ ปริมาณปรอทในปัสสาวะของทันตบุคลากรทุกกลุ่มแตกต่างจากกลุ่มบุคคลทั่วไปซึ่งพบค่าเฉลี่ยได้เพียง 1.83 µg/L อย่างมีนัยสำคัญทางสถิติ กลุ่มผู้ช่วยทันตแพทย์ที่ไม่ได้รับราชการมีระดับปรอทในปัสสาวะโดยเฉลี่ยสูงกว่ากลุ่มทันตแพทย์ และกลุ่มผู้ช่วยทันตแพทย์ที่รับราชการอย่างมีนัยสำคัญทางสถิติ แต่ไม่แตกต่างจากลุ่มทันตแพทย์ที่ไม่ได้รับราชการอย่างมีนัยสำคัญทางสถิติ และผู้ช่วยทันตแพทย์ที่ไม่ได้รับราชการมีปรอทในปัสสาวะสูงเกินระดับปลอดภัยร้อยละ 11.1
3. ปัจจัยที่ส่งผลต่อปริมาณสารปรอทในปัสสาวะของผู้ปฏิบัติงานทันตกรรมที่สัมผัสอะมัลกัมในโรงพยาบาลชุมชน จังหวัดจันทบุรี
ประเทศไทยยังไม่มีการศึกษาถึงปัจจัยข้อมูลด้านสิ่งแวดล้อมจากการทำงาน โดยเฉพาะปริมาณความเข้มข้นของปรอทในอากาศ ซึ่งอาจเป็นปัจจัยที่มีผลต่อปริมาณสารปรอทในปัสสาวะของผู้ปฏิบัติงานทันตกรรม การศึกษานี้มีวัตถุประสงค์เพื่อศึกษาปัจจัยที่ส่งผลกับปริมาณสารปรอทในปัสสาวะของผู้ปฏิบัติงานทันตกรรม (ที่สัมผัสอะมัลกัมในโรงพยาบาลชุมชน จังหวัดจันทบุรี) โดยเป็นการศึกษา Cross-sectional โดยเก็บข้อมูลในช่วงวันที่ 1 กันยายนถึงวันที่ 15 ตุลาคม พ.ศ. 2556 กลุ่มที่ศึกษาประกอบด้วยผู้ปฏิบัติงานทันตกรรม ได้แก่ ทันตแพทย์ ทันตาภิบาล ผู้ช่วยทันตกรรม จำนวน 62 คน และกลุ่มควบคุมคือ เจ้าหน้าที่ที่ปฏิบัติงานในแผนกเวชระเบียนจำนวน 21 คน สังกัดโรงพยาบาลชุมชน จำนวน 11 แห่ง มีเครื่องมือและวิธีการเก็บรวบรวมข้อมูลคือ 1. แบบสอบถาม ประกอบด้วย 3 ส่วน คือ ข้อมูลลักษณะทางประชากรสังคม ประวัติการทำงาน และ ความรู้เกี่ยวกับปรอท 2. อุปกรณ์ที่ใช้ในการเก็บตัวอย่างปรอทในอากาศ เก็บไอระเหยของปรอท ซึ่งการเก็บไอระเหยของปรอทในบรรยากาศการทำงานใช้มาตรฐานของ NIOSH (Method 6009) ในกลุ่มประชากรที่ศึกษาและกลุ่มควบคุมแบบติดตัวบุคคลโดยเก็บเพียงครั้งเดียวในระหว่างการปฏิบัติงานเป็นระยะเวลา 120 นาทีต่อคน และ 3. เก็บตัวอย่างปรอทในปัสสาวะ โดยใช้ขวดพลาสติกปิดฝา ขนาด 30 มิลลิลิตร โดยเก็บปัสสาวะก่อนเข้าทำงาน (Prior to shift คือ การเก็บปัสสาวะหลังสิ้นสุดการรับสัมผัส 16 ชั่วโมง) ตามมาตรฐานการเก็บโลหะปรอทในปัสสาวะของ ACGIH (2012) ปริมาณไม่น้อยกว่า 25 มิลลิลิตร ส่งตรวจวิเคราะห์หาระดับความเข้มข้นของปรอทในปัสสาวะโดยวิธี Inductive Coupled Plasma Spectrometer Mass Spectrometer (ICP-MS)
ผลการศึกษาพบว่า กลุ่มที่ศึกษาเป็นเพศหญิงร้อยละ 87.10 เพศชายร้อยละ 12.90 มีอายุเฉลี่ย 33.99 ปี อายุงานเฉลี่ย 9.40 ปี ชั่วโมงการทำงานเฉลี่ย 10.74 ชั่วโมงต่อวัน ปริมาณสารปรอทในปัสสาวะของกลุ่มศึกษาและกลุ่มควบคุมมีค่าเฉลี่ยเท่ากับ 3.60 ไมโครกรัม/กรัม ครีเอตินีน และ 1.82 ไมโครกรัม/กรัม ครีเอตินีน ตามลำดับ ปริมาณการรับสัมผัสสารปรอทในอากาศของกลุ่มศึกษาและกลุ่มควบคุม มีค่าเฉลี่ยเท่ากับ 0.73 ไมโครกรัม/ลูกบาศก์เมตร และ 0.10 ไมโครกรัม/ลูกบาศก์เมตร ตามลำดับ จากการเปรียบเทียบเพื่อหาความแตกต่าง พบว่าผู้ปฏิบัติงานทันตกรรมมีปริมาณสารปรอทในปัสสาวะไม่แตกต่างจากกลุ่มควบคุม แต่ในกลุ่มผู้ปฏิบัติงานทันตกรรมกับตำแหน่งงาน มีความแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (p < 0.05) ส่วนปริมาณการรับสัมผัสสารปรอทในอากาศของกลุ่มศึกษาและกลุ่มควบคุมมีความแตกต่างกันอย่างมีนัยสำคัญทางสถิติ (p < 0.001) นอกจากนี้ การศึกษาความสัมพันธ์ระหว่างปัจจัยการรับสัมผัสสารปรอทในอากาศ อายุงาน ชั่วโมงการทำงานต่อวัน และความรู้เกี่ยวกับปรอท กับปริมาณสารปรอทในปัสสาวะของกลุ่มศึกษาพบว่า ปริมาณสารปรอทในปัสสาวะ มีความสัมพันธ์ทางบวกกับปริมาณการรับสัมผัสสารปรอทในอากาศอย่างมีนัยสำคัญทางสถิติ (p = 0.04, r = 0.25) ส่วนปัจจัยอื่นๆ ไม่มีความสัมพันธ์กัน
สรุปผลได้ว่าผู้ปฏิบัติงานทันตกรรมในโรงพยาบาลชุมชนส่วนใหญ่มีระดับปรอทในปัสสาวะ และระดับความเข้มข้นของปรอทในบรรยากาศการทำงานอยู่ในระดับต่ำกว่าค่ามาตรฐาน TLV ที่ ACGIH กำหนด ด้านความรู้เกี่ยวกับปรอทของผู้ปฏิบัติงานทันตกรรม พบว่าส่วนใหญ่มีความรู้ระดับต่ำถึงปานกลาง ข้อเสนอแนะจากการวิจัยในครั้งนี้คือ เจ้าหน้าที่แผนกทันตกรรมมีความเสี่ยงต่อการสัมผัสสารปรอทมากกว่าบุคลากรทางการแพทย์กลุ่มอื่นๆ ดังนั้นควรมีการตรวจสุขภาพเพื่อหาปริมาณสารปรอทในปัสสาวะทุกปี ร่วมกับการตรวจวัดปรอทในอากาศทุกปี และมีการบริหารจัดการด้านวิศวกรรมที่แหล่งกำเนิดของไอปรอทให้ได้มาตรฐาน
ผลกระทบของปรอทต่อบุคคลากรด้านทันตกรรม
มีการศึกษาจำนวนมากได้แสดงให้เห็นว่าการทำงานของบุคลากรทางทันตกรรม มีความเสี่ยงในการได้รับสารปรอทมากกว่าอาชีพอื่น องค์การอนามัยโลก (WHO) ได้แนะนำให้ลดการใช้อะมัลกัมและเปลี่ยนไปใช้วัสดุทางเลือก แต่อย่างไรก็ตาม วัสดุอุดอื่นๆอาจยังไม่เหมาะสมสำหรับประเทศที่มีรายได้ปานกลางและต่ำ แม้จะมีความกังวลเกี่ยวกับความเป็นพิษของปรอท แต่อะมัลกัมยังคงเป็นวัสดุที่ใช้กันอย่างแพร่หลายทั่วโลก ประเทศนอร์เวย์ สวีเดน สวิสเซอร์แลนด์ และญี่ปุ่นได้ยกเลิกการใช้อะมัลกัม เนื่องจากเหตุผลทางสิ่งแวดล้อม ส่วนในประเทศเดนมาร์ก ฟินแลนด์ เอสโตเนีย และอิตาลี มีการใช้อะมัลกัมน้อยกว่า 5% ของการบูรณะฟันทั้งหมด ทางการแพทย์ของประเทศฝรั่งเศส ฟินแลนด์ ออสเตรีย เยอรมนี และแคนาดา แนะนำลดการใช้อะมัลกัมในเด็ก หญิงตั้งครรภ์ และผู้ป่วยโรคไต
แนวทางการใช้ปรอทอย่างปลอดภัย
Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR) ได้ให้ความเห็นไว้ในเอกสารฉบับล่าสุดในปี 2015 ว่า แม้จะมีการศึกษามากมายที่พยายามหาความสัมพันธ์หรือความเชื่อมโยงระหว่างสารปรอทในอะมัลกัมและโรคต่างๆทางระบบประสาทหรือทางจิต (รวมถึง Alzheimer’s, Parkinson’s, multiple sclerosis และ kidney disease) ไม่พบความเชื่อมโยง และพบแต่ข้อมูลที่มีแต่ความขัดแย้งกัน ปัจจุบันยังมีข้อมูลไม่เพียงพอเกี่ยวกับความปลอดภัยเพื่อสนับสนุนข้อเท็จจริงที่ว่าปรอทในอะมัลกัมเป็นพิษอย่างมากต่อมนุษย์ ปัจจุบัน FDA หรือองค์การอาหารและยา แนะนำว่าการอุดฟันโดยใช้อะมัลกัมปลอดภัยสำหรับผู้ใหญ่และเด็กอายุ 6 ปีขึ้นไป ปริมาณปรอทที่วัดได้ในร่างกายของผู้ที่มีการอุดฟันด้วยอะมัลกัมอยู่ในระดับต่ำกว่าระดับที่จะเกิดผลกระทบต่อสุขภาพ
โครงการสิ่งแวดล้อมแห่งสหประชาชาติ หรือ UNEP ประกาศ Mercury Use in Healthcare Settings and Dentistry ในปี ค.ศ.2008 เน้นย้ำไม่ให้มีการอุดหรือรื้อวัสดุอุดอะมัลกัมในหญิงตั้งครรภ์ หากจำเป็นต้องรื้ออะมัลกัมในผู้ป่วยทั่วๆไป ต้องมีการปฏิบัติที่เหมาะสม เช่น ควรใส่แผ่นยางกั้นน้ำลาย และใช้ high-power evacuator ทันตแพทย์รวมทั้งทันตบุคคลากรในคลินิกต้องเรียนรู้วิธีเก็บปรอทและวิธีการกำจัดสารปรอทที่รั่วไหลอย่างถูกต้อง โดยให้คำแนะนำว่าควรทำการกำจัดอะมัลกัมในลักษณะเป็นก้อนแทนที่จะบด และใช้ตาข่ายละเอียดเพื่อดักจับเศษอะมัลกัม นอกจากนี้ในงานทันตกรรมบางประเทศมีกฎหมายว่าน้ำเสียที่ปล่อยออกมาจากคลินิกทันตกรรม จะต้องได้รับการตรวจสอบ และไม่ควรมีปรอทในน้ำเสียเกิน 100-2000 ppm ส่วนการจัดการฟันที่ถูกถอนที่มีวัสดุอุดอะมัลกัมให้จัดการเช่นเดียวกับเศษอะมัลกัม และควรทิ้งเศษอะมัลกัมในภาชนะพลาสติกที่ปิดสนิทแช่ในน้ำยา fixer (สำหรับภาพรังสี) และมีการรับซื้อไปเพื่อ recycle บางประเทศกำหนดเป็นกฎหมายให้มีการติดตั้ง amalgam separator ในคลินิกทันตกรรม การจัดการขยะอะมัลกัมให้จัดการในลักษณะขยะมีพิษใส่ถุงสีเทา และต้องมีการกำจัดในลักษณะ land-fill ห้ามเผาทิ้งเป็นอันขาด เป็นต้น
วัสดุอะมัลกัมยังคงเป็นหนึ่งในวัสดุที่มีประสิทธิภาพมาก ทนทานต่อการบดเคี้ยว ง่ายต่อการใช้งาน ราคาถูก และอายุการใช้งานยาวนาน บุคลากรทางทันตกรรมเป็นอาชีพที่ได้สัมผัสกับสารปรอทที่มีปริมาณความเข้มข้นสูงกว่ากลุ่มประชากรทั่วไป แต่ยังไม่มีการศึกษาใดในมนุษย์ที่จะยืนยันได้ว่าการได้รับสารปรอทเป็นพิษอย่างมากจนทำให้เกิดโรค โดยเมื่อเลือกใช้วัสดุอุดอะมัลกัม ทันตแพทย์ควรคำนึงถึงความปลอดภัยทั้งต่อตนเอง เพื่อนร่วมงาน และผู้ป่วยไว้เสมอ รวมทั้งต้องสามารถให้ความรู้เกี่ยวกับอันตรายของพิษปรอท วิธีการป้องกัน และการดูแลสุขภาพอนามัยของตนเอง เพื่อเป็นการป้องกันตนเองและบุคคลากรข้างเคียงจากการทำงานในสิ่งแวดล้อมที่อาจเป็นพิษได้
ผลกระทบของปรอทในวัสดุอุดฟันอะมัลกัมต่อสุขภาพหญิงมีครรภ์ ทารกในครรภ์ ทารก เด็ก และวัยรุ่น
สารปรอทมีคุณสมบัติเป็น lipophilic จึงสามารถผ่าน blood-brain barrier และผ่านรกได้ เมื่อผ่านเข้าไปแล้วจะถูก oxidized ให้อยู่ในรูป inorganic mercury ซึ่งไม่สามารถซึมผ่านกลับออกมา ปรอทจึงสามารถสะสมในสมองและในเนื้อเยื่อของตัวอ่อน (fetal tissue) อย่างไรก็ตามพบว่ามีการศึกษาในมนุษย์ไม่มากนัก และไม่พบความสัมพันธ์ที่ชัดเจนเกี่ยวกับผลของปรอทต่อหญิงมีครรภ์
การวัดปริมาณปรอทที่เข้าสู่ร่างกาย ส่วนใหญ่ใช้ปริมาณปรอทในปัสสาวะ (mercury urine level; UHg) เป็น biomarker โดย American Conference of Governmental Industrial Hygienist กำหนดค่า biological threshold limit ต่อไต อยู่ที่ 35 μg Hg/g creatinine อย่างไรก็ตาม ค่าเหล่านี้ใช้สำหรับผู้ใหญ่ที่ทำงานเกี่ยวข้องกับสารปรอท ไม่ใช่ค่าความปลอดภัยที่ใช้ในเด็ก สำหรับในผู้ใหญ่ที่ไม่ได้ทำงานเกี่ยวข้องกับสารปรอท องค์การอนามัยโลกกำหนดค่า background level อยู่ที่น้อยกว่า 5 μg Hg/g creatinine นอกจากนี้ biomarker ที่นิยมใช้นอกจากปริมาณปรอทในปัสสาวะ ได้แก่ ปริมาณสารปรอทในเลือด โดย International Commission on Occupational Health (ICOH) และ International Union of Pure and Applied Chemistry (IUPAC) ได้กำหนดค่าปริมาณปรอทในเลือดในกลุ่มประชากร ที่ไม่ได้รับประทานปลาเป็นประจำอยู่ที่ 2 μg /L ในขณะที่องค์การอนามัยโลกกำหนดค่าปริมาณปรอทในเลือดในกลุ่มประชากรที่ไม่ได้ทำงานสัมผัสกับสารปรอทอยู่ที่ต่ำกว่า 5 μg /L การใช้ค่าปริมาณปรอทในผม เป็นอีกวิธีที่สามารถบอกปริมาณปรอทที่สะสมในร่างกายโดยเป็นการบ่งบอกถึงการได้รับ methyl mercury เป็นระยะเวลายาวนาน (chronic exposure) สำหรับการศึกษาในมารดาที่ให้นมบุตร ค่าที่นิยมใช้ได้แก่ ปริมาณสารปรอทใน colostrum และในน้ำนม อย่างไรก็ตาม การศึกษาปริมาณสารปรอทในสารคัดหลั่งต่างๆของร่างกาย สามารถตรวจพบได้ทั้ง methyl mercury ซึ่งมักมีแหล่งที่มาจากการรับประทานอาหาร เช่น ปลา ในขณะที่ inorganic mercury มักมีที่มาจากการหายใจ ดังนั้น ในการวิเคราะห์ผลการศึกษาควรต้องพิจารณาอย่างรอบคอบถึงชนิดของสารปรอทด้วย
การศึกษาปริมาณปรอทในหญิงมีครรภ์และทารก
การศึกษาของ Lugie และคณะ (2005) ทำการศึกษาปริมาณปรอทใน amniotic fluid ในหญิงมีครรภ์จำนวน 72 คน พบว่าปริมาณปรอทใน amniotic fluid มีแนวโน้มเพิ่มมากขึ้นตามจำนวนฟันที่บูรณะด้วยวัสดุอะมัลกัม และการบริโภคปลา แต่ไม่มีนัยสำคัญทางสถิติ Palkovicova และคณะ (2008) ทำการศึกษาในมารดาและทารกจำนวน 99 คู่ พบความสัมพันธ์ของปริมาณปรอทในเลือดของมารดา และปริมาณปรอทใน cord blood กับจำนวนของวัสดุอะมัลกัมในช่องปากมารดา เช่นเดียวกับ Bjornberg และคณะ (2005) ทำการศึกษาในมารดาและทารกชาวสวีเดนจำนวน 20 คน โดยทำการตรวจวัดค่า metyl mercury (MeHg) และ inorganic mercury (I-Hg) พบว่าปริมาณ inorganic mercury ในเลือดทารกมีความสัมพันธ์กับ inorganic mercury ในเลือดมารดาอย่างมีนัยสำคัญ และค่อยๆลดปริมาณลงเมื่อทารกอายุ 13 สัปดาห์ และพบว่าปริมาณปรอทที่ทารกได้รับในขณะได้รับ breast milk มีแหล่งมาจาก methyl mercury มากกว่า inorganic mercury
การศึกษาผลกระทบของวัสดุอะมัลกัมในช่องปากมารดาต่อทารกในครรภ์
มีการศึกษาถึงผลประทบที่เกิดขึ้นกับทารกที่มารดาได้รับวัสดุอะมัลกัมก่อนและขณะตั้งครรภ์ โดย Lygre และคณะ (2016) ทำการศึกษาในหญิงมีครรภ์ชาวนอร์เวย์ จำนวน 69,474 คน พบว่าไม่มีความสัมพันธ์ระหว่างจำนวนฟันที่มีวัสดุอะมัลกัม ต่อการคลอดก่อนกำหนด low birth weight ความผิดปกติของทารก (malformation) และการคลอดทารกที่ตายในครรภ์ (stillbirth) ซึ่งสอดคล้องกันการศึกษาของ Hujoel และคณะ (2005) ที่ทำ case control study ในประเทศสหรัฐอเมริกา โดยศึกษาในกลุ่มมารดาที่คลอดทารกน้ำหนักน้อยกว่า 2,500 กรัม จำนวน 1,117 คน และกลุ่มที่คลอดทารกน้ำหนักมากกว่า 2,500 กรัม จำนวน 4,468 คน พบว่าไม่มีความสัมพันธ์ระหว่างการมีวัสดุอะมัลกัมและภาวะ low birth weight ของทารก นอกจากนี้ยังคงมีการศึกษาแบบ cohort ในหญิงมีครรภ์จำนวน 7,375 คน (ALSPAC cohort study) ที่สนับสนุนว่ามารดาที่มีวัสดุอะมัลกัม ในช่องปาก หรือรื้อวัสดุวัสดุอะมัลกัมในช่วงตั้งครรภ์ ไม่มีผลต่อภาวะ low birth weight ของทารก องค์กรอาหารและยาของสหรัฐอเมริกา (Food and Drug Administration, FDA) สรุปว่าไอปรอทสามารถผ่าน placenta ได้ และจากหลักฐานที่มี ไม่พบความสัมพันธ์ระหว่างการได้รับสารปรอทจากอะมัลกัมกับการเกิดผลข้างเคียงระหว่างตั้งครรภ์ ทั้งในแง่ภาวะ low birth weight ของทารกและภาวะทารกตายในครรภ์
การศึกษาผลของวัสดุอะมัลกัมในช่องปากมารดาต่อสมองและพัฒนาการของทารก
การศึกษา ALSPAC cohort study ในหญิงมีครรภ์จำนวน 7,375 คน พบว่า ไม่มีความสัมพันธ์ระหว่างการมีวัสดุอะมัลกัมในช่องปากมารดาก่อนตั้งครรภ์ ต่อพัฒนาการทางด้านภาษาและการพูดในเด็กอายุ 15 เดือน ซึ่งสอดคล้องกับ Seychelles Child Development Nutrition Study (SCDNS) ซึ่งศึกษาหาความสัมพันธ์ระหว่างจำนวนด้านของวัสดุอะมัลกัมในช่องปากมารดาและขนาดของวัสดุอุดอะมัลกัม (occlusal point) ต่อพัฒนาการทางสมองด้านต่างๆในเด็กอายุ 6 เดือนและ 30 เดือน จากการศึกษาพบว่าจำนวนด้านของวัสดุอะมัลกัมในช่องปากมารดาไม่มีผลต่อพัฒนาการทางด้านสมองของเด็กทั้งสองกลุ่มอายุ แต่หากพิจารณาขนาดของวัสดุอุดอะมัลกัมพบว่ามีผลต่อพัฒนาการด้าน mental development index ในกลุ่มเด็กหญิงที่อายุ 9 เดือน แต่เมื่อติดตามต่อไปเมื่อเด็กอายุ 66 เดือน ผู้วิจัยพบว่า ขนาดของวัสดุอุดอะมัลกัมส่งผล adverse effect ในเด็กชาย ผู้วิจัยให้ข้อสรุปว่า ผลที่เกิดขึ้นไม่สามารถยืนยันได้ว่าเกิดจากวัสดุอะมัลกัมในช่องปากมารดา ซึ่งผลดังกล่าวได้รับการยืนยันเมื่อตามผู้ป่วยต่อไปจนอายุครบ 5 ปี พบว่าจำนวนด้านของวัสดุอะมัลกัมในช่องปากมารดาและขนาดของวัสดุอุดอะมัลกัม ไม่มีผลต่อพัฒนาการทางด้านสมองของเด็กทั้งเพศชายและหญิง
การศึกษาผลของวัสดุอะมัลกัมในช่องปากมารดาต่อปริมาณปรอทในน้ำนมมารดา
การศึกษาเกี่ยวกับปริมาณปรอทในน้ำนมส่วนหนึ่งพบว่าปริมาณปรอทในน้ำนมมารดามีความสัมพันธ์ กับจำนวนฟันที่มีวัสดุอะมัลกัม และพบว่าปริมาณปรอทจะมากที่สุดในน้ำนม colostrum ที่เก็บในช่วงวันแรกๆหลังคลอด หลังจากนั้นปริมาณปรอทจะลดลง โดยจากการศึกษาของ Vimy และคณะ (1997) พบว่าปรอทในน้ำนมที่เก็บจากมารดาที่มีวัสดุอะมัลกัมในช่องปาก 2-14 ซี่ มีปริมาณ 0.237 μg Hg/L ในขณะที่กลุ่มมารดาที่ไม่มีวัสดุอะมัลกัม มีปริมาณปรอทเท่ากับ 0.146 μg Hg/L ซึ่งองค์กรอาหารและยาของสหรัฐอเมริกา (FDA) ได้นำค่าจากการศึกษานี้มาคำนวณหาปริมาณปรอทในนมที่เกิดจากอะมัลกัมในช่องปากมารดาโดยนำปริมาณปรอทในน้ำนมมารดาที่ไม่มีวัสดุอะมัลกัมมาลบออกจากลุ่มที่มีวัสดุอะมัลกัม ได้ค่าเท่ากับ 0.09 μg Hg/L ในหนึ่งวันทารกน้ำหนักตัวประมาณ 5 กิโลกรัม ได้รับนมเฉลี่ยวันละ 0.85 ลิตรต่อวัน เมื่อนำมาคำนวณ พบว่าเด็กได้รับปริมาณปรอท (inorganic mercury) เท่ากับ 0.015 μg Hg/kg/day ซึ่งน้อยกว่าค่ากำหนดของ EPA (The Environmental Protection Agency) ซึ่งได้กำหนดค่า reference dose สำหรับการได้รับ inorganic mercury เท่ากับ 0.3 μg Hg/kg/day องค์กรอาหารและยาของสหรัฐอเมริกา จึงได้สรุปว่าจากหลักฐานที่มีพบว่าทารกไม่ได้รับผลกระทบต่อสุขภาพจากการได้รับนมมารดาที่มีวัสดุอะมัลกัมในช่องปาก
ผลกระทบของปรอทในวัสดุอุดฟันอะมัลกัมต่อเด็ก
การศึกษาปริมาณปรอทปัสสาวะของเด็กและการทำงานของไต
ในปี 2014 Levy และคณะ ทำการศึกษาในเด็กอายุ 4-8 ปี พบว่าเด็กที่มีวัสดุอุดฟันอะมัลกัมด้านบดเคี้ยวตั้งแต่ 7 ด้านขึ้นไปมีปริมาณปรอทในปัสสาวะ (UHg) สูงกว่าเด็กที่ไม่มีอะมัลกัมในช่องปากอย่างมีนัยสำคัญ (ปริมาณปรอทในปัสสาวะเฉลี่ย 1.412 μg Hg/g creatinine และ 0.436 μg Hg/g creatinine ตามลำดับ P = 0.0001) นอกจากนี้ยังพบปัจจัยอื่น ๆ ที่มีความสัมพันธ์กับปริมาณปรอทในปัสสาวะ ได้แก่ อายุเด็ก ส่วนสูง และน้ำหนัก โดยเด็กที่มีอายุน้อย ความสูงน้อย และน้ำหนักน้อย มีโอกาสพบปริมาณปรอทในปัสสาวะสูงกว่า Levy และคณะได้คำนึงถึงการได้รับปรอทจากแหล่งอื่นด้วย จึงได้นำปัจจัยด้านความถี่ของการรับประทานปลามาวิเคราะห์ในการศึกษาแบบพหุปัจจัย ผลการศึกษาพบว่าเด็กที่รับประทานปลาอย่างน้อย 2 ครั้งต่อ สัปดาห์ มีปริมาณปรอทในปัสสาวะสูงกว่าเด็กที่รับประทานปลาน้อยกว่า 8.66 เท่า ในขณะที่เด็กที่มีวัสดุอุดฟันอะมัลกัมด้านบดเคี้ยวตั้งแต่ 7 ด้านขึ้นไปมีปริมาณปรอทในปัสสาวะสูงกว่าเด็กที่ไม่มีอะมัลกัมถึง 47.18 เท่า มีการศึกษาเปรียบเทียบเด็กที่อุดฟันด้วยอะมัลกัมและคอมโพสิท ติดตามผลที่ระยะเวลา 5 ปี พบว่ากลุ่มที่อุดฟันด้วยอะมัลกัมมีค่า urine mercury สูงกว่าแต่มีการทำงานของไตซึ่งวัดผลจากค่า urine albumin ไม่แตกต่างกัน นอกจากนี้เด็กทั้งสองกลุ่มยังมี IQ และความจำไม่แตกต่างกันอย่างมีนัยสำคัญอีกด้วย อย่างไรก็ตาม ในปัจจุบันมีการศึกษาไปถึงผลของอะมัลกัมต่อ biomarker ที่เกี่ยวกับการทำงานของไต และการเกิด oxidative stress อื่นๆร่วมด้วย โดยใช้ biomarker ได้แก่
– N-acetyl- β – D-glucosaminidase (NAG), alpha -1- microglobulin (α-MG) และ beta macroglobulin (β-MG) ใช้บ่งบอกว่ามีการเสียหายของท่อไต (renal tubular damage)
– 8-OHdG ใช้บ่งบอกว่ามีการเกิดการทำลาย DNA (oxidative DNA damage)
– malondialdehyde (MDA) ใช้บ่งบอกว่ามีการเกิด lipid peroxidation ซึ่งเป็นสาเหตุของหลายชนิด เช่น โรคเบาหวาน โรคหัวใจ เป็นต้น
ผลการศึกษา biomarker ดังกล่าว ในเด็กอายุ 5-15.5 ปี พบว่า ปริมาณ NAG ในปัสสาวะมีความสัมพันธ์กับการมีอะมัลกัมในช่องปากและมีความสัมพันธ์กับระดับปรอทในปัสสาวะ (mercury urine level: UHg) อย่างมีนัยสำคัญ โดยความสัมพันธ์ของ NAG กับระดับปรอทในปัสสาวะ เป็นแบบ Dose-effect pattern และเริ่มพบ NAG เมื่อระดับปรอทในปัสสาวะมากกว่า 1.452 μg Hg/g creatinine เป็นต้นไป ส่วนค่า α-MG พบว่ามีความสัมพันธ์เชิงบวกกับระดับปรอทในปัสสาวะเช่นกัน แสดงให้เห็นว่าการได้รับสารปรอทจากวัสดุอุดฟันอะมัลกัม อาจส่งผลต่อการทำงานของท่อไตในเด็กได้ ส่วนในแง่ของการเกิด oxidative stress พบว่า 8-OHdG มีความสัมพันธ์เชิงลบกับการมีอะมัลกัมในช่องปาก แสดงให้เห็นว่าปรอทในอะมัลกัมไม่ได้เพิ่มการทำลาย DNA แต่อาจไปลดความสามารถในการซ่อมแซม DNA ทำให้ 8-OHdG ในปัสสาวะลดน้อยลง อย่างไรก็ตาม การศึกษานี้ไม่ได้ควบคุมการได้รับสารปรอทจากแหล่งอื่นด้วย
การศึกษา “Casa Pia Study” ซึ่งเป็นการศึกษาแบบ randomized control trial เป็นเวลา 7 ปี ในเด็กจำนวน 507 คน อายุ 8-10 ปี พบว่า ปริมาณปรอทในปัสสาวะมีความสัมพันธ์กับจำนวนด้านของวัสดุอะมัลกัมอย่างมีนัยสำคัญ แต่อย่างไรก็ตาม กลุ่มเด็กที่มีวัสดุอะมัลกัมมีค่าปรอทในปัสสาวะสูงสุด 3.2 μg Hg/L และค่อยๆลดลง เมื่อติดตามผลจนถึง 7 ปี เมื่อนำค่าจากการศึกษาต่างๆ มาเปรียบเทียบกับค่าที่ American Conference of Governmental Industrial Hygienist (ACGIH, 2007) กำหนด biological threshold limit ต่อไตอยู่ที่ 35 μg Hg/g creatinine ในผู้ใหญ่ที่ทำงานเกี่ยวข้องกับสารปรอท และ 5 μg Hg/g creatinine (WHO, 2003) สำหรับในผู้ใหญ่ที่ไม่ได้ทำงานเกี่ยวข้องกับสารปรอท พบว่าปริมาณปรอทในปัสสาวะที่ได้จากการศึกษาต่างๆ ยังไม่เกิน threshold limit Scientific Committee on Emerging and Newly Identified Health Risks (SCENHIHR) ได้ให้ข้อสรุปว่า มีเพียงหลักฐานจำนวนน้อยที่พบว่าปรอทจากอะมัลกัมอาจส่งผลต่อการทำงานของไต
การศึกษาผลของวัสดุอะมัลกัมในช่องปากเด็กต่อสมองและพัฒนาการของเด็ก
De Rouen และคณะ (2006) ได้รายงานผลด้าน neurobehavior ในเด็ก 507 คน ซึ่งเป็น กลุ่มประชากรเดียวกับ “Casa Pia Study” ซึ่งเป็น randomized control trial เวลา 7 ปี อายุเมื่อเริ่มการศึกษา 8-10 ปี พบว่ากลุ่มเด็กที่ได้รับการอุดฟันด้วยอะมัลกัมมีค่าเฉลี่ยเท่ากับ 18 ด้าน ส่วน เด็กที่ได้รับการอุดฟันด้วยคอมโพสิตมีค่าเฉลี่ยเท่ากับ 21 ด้าน เมื่อติดตามผลจนถึง 7 ปี พบว่ากลุ่มอะมัลกัมมีค่าปริมาณปรอทในปัสสาวะสูงกว่ากลุ่มคอมโพสิต 1-1.5 μg Hg/L แต่เมื่อทดสอบ neurobehavior ไม่พบความแตกต่างของ memory, attention, visuomotor function และ nerve conduction velocity ระหว่างเด็กทั้งสองกลุ่ม แต่อย่างไรก็ตามกลุ่มเด็กที่มีวัสดุคอมโพสิตต้องได้รับการ บูรณะฟันใหม่ ทดแทนวัสดุอุดเดิมถึงร้อยละ ผลการศึกษาดังกล่าวสอดคล้องกับการศึกษาของ Bellinger และคณะ (2006 และ 2007) ซึ่งการทำ การศึกษา randomized control trial เวลา 5 ปี ในเด็ก 534 คน อายุเมื่อเริ่มการศึกษา 6-10 ปี ที่มีฟันกรามผุอย่างน้อย 2 ซี่ พบว่ากลุ่มอะมัลกัมมีค่าปริมาณปรอทในปัสสาวะ (0.9 μg Hg/L) สูงกว่ากลุ่มคอมโพสิต (0.6 μg Hg/L) อย่างมีนัยสำคัญทางสถิติ แต่ไม่พบความแตกต่างของ IQ การทดสอบความจำ และ visuomotor ability นอกจากนี้การศึกษานี้ยังสรุปว่า ค่าปริมาณปรอทในปัสสาวะไม่มีความสัมพันธ์กับ neuropsychological function การศึกษาในประเทศจีนก็ให้ผลเช่นเดียวกัน โดย Ye และคณะ (2009) ทำการศึกษาในเด็กอายุ 7-11 ปี พบว่าไม่มีความแตกต่างอย่างมีนัยสำคัญระหว่างปริมาณปรอทในปัสสาวะของกลุ่มอะมัลกัม (1.6 μg Hg/g creatinine) และ กลุ่มที่ไม่มีอะมัลกัม (1.4 μg Hg/g creatinine) อีกทั้งยังไม่พบความแตกต่างของ IQ neurobehavior และ neuropsychological function จากหลักฐานที่มี Scientific Committee on Emerging and Newly Identified Health Risks (SCENHIHR) ได้ให้ข้อสรุปว่าอะมัลกัมไม่มีผลต่อ neuropsychological development ของเด็ก
การศึกษาผลของวัสดุอะมัลกัมในช่องปากต่อการทำงานของระบบภูมิคุ้มกัน
ถึงแม้ว่าการศึกษาส่วนใหญ่จะมุ่งเน้นศึกษาเกี่ยวกับผลการทบของปรอทต่อการทำงานของไตและการพัฒนาระบบประสาท แต่ในปัจจุบันเริ่มมีการศึกษาเกี่ยวกับผลกระทบต่อระบบภูมิคุ้มกันของร่างกายมากขึ้น เนื่องจากมีรายงานว่าการได้รับสารปรอทปริมาณน้อยๆ เป็นเวลานานจะส่งผลให้เกิด immune suppression ความสามารถของระบบภูมิคุ้มกันลดลง และอาจกระตุ้นให้เกิด autoimmune หรือ hypersensitivity reaction ได้ และการศึกษาในห้องปฏิบัติการพบว่าการได้รับสารปรอททำให้เกิดการตายของเซลล์ lymphocyte และ monocyte Shenker และคณะ (2008) ได้ทำการศึกษาเปรียบเทียบปริมาณและการทำงานของเม็ดเลือดขาว ในเด็กอายุ 6-10 ปีที่ได้รับการอุดฟันด้วยอะมัลกัมเปรียบเทียบกับกลุ่มที่อุดฟันด้วยคอมโพสิท พบว่าที่ระยะ เวลา 5-7 วันหลังอุด เด็กกลุ่มที่อุดฟันด้วยอะมัลกัมมีการตอบสนองของ T-cell และ monocyte ลดลงเล็กน้อยแต่ไม่แตกต่างอย่างมีนัยสำคัญกับเด็กกลุ่มที่อุดด้วยคอมโพสิท ส่วนที่ระยะเวลา 6, 12 และ 60 เดือนหลังอุด ไม่พบความแตกต่างอย่างมีนัยสำคัญของปริมาณและการทำงานของเม็ดเลือดขาวระหว่างเด็กทั้งสองกลุ่ม จึงสรุปได้ว่า การอุดฟันด้วยอะมัลกัมไม่มี immunotoxic effect ต่อเด็ก
จากข้อมูลข้างต้น องค์การอาหารและยาของสหรัฐอเมริกา (FDA) ได้สรุปว่า จากหลักฐานที่มี ไม่พบการศึกษาทางคลินิกที่ยืนยันผลจากการได้รับไอปรอทจากวัสดุอะมัลกัมในเด็กอายุต่ำกว่า 6 ปี FDA สรุปว่าปริมาณปรอทจากอะมัลกัมในเด็กอายุต่ำกว่า 6 ปี ไม่เกินค่ามาตรฐาน estimated daily dose ในผู้ใหญ่ (1-5 μg Hg/day) นอกจากนี้ FDA ให้ข้อสรุปว่าปริมาณปรอทจากวัสดุอะมัลกัม ในช่องปากผู้ป่วยมีค่าต่ำกว่า threshold level และไม่ส่งผลต่อสุขภาพในกลุ่มประชากรที่มีอายุมากกว่า 6 ปี
ผลข้างเคียงอันไม่พึงประสงค์ ปฏิกริยาตอบสนองเฉพาะที่ของเนื้อเยื่อในช่องปาก และความเสี่ยงอื่น ๆ ที่อาจเกิดขึ้นในผู้ที่ได้รับการบูรณะด้วยวัสดุอะมัลกัม
(Adverse effects, localized mucosal reactions, and possible risks in individuals with amalgam restorations)
ผลข้างเคียงต่อสุขภาพจากปรอทในอะมัลกัม (Possible risks after exposure to dental amalgam)
ความเป็นพิษของปรอทต่อสิ่งแวดล้อมและสุขภาพร่างกายได้รับความสนใจในวงกว้าง โดยปรอทจากอะมัลกัมเป็นเพียงรูปแบบหนึ่งของปรอทที่ถูกปล่อยสู่สิ่งแวดล้อมและเข้าสู่ร่างกายของมนุษย์ ปัจจุบันหลาย ๆ ประเทศมีนโยบายเลิกหรือลดการใช้วัสดุอะมัลกัมในทางทันตกรรม จึงเกิดคำถามว่าการสัมผัสปรอทจากวัสดุอะมัลกัมนั้นเป็นปริมาณมากพอที่เมื่อเข้าสู่ร่างกายแล้วเป็นอันตรายต่อสุขภาพร่างกายหรือไม่ ปรอทจะอยู่ในสภาวะเฉื่อย (inert) เมื่ออะมัลกัมก่อตัวแล้ว ปรอทจากอะมัลกัมมีโอกาสเข้าสู่ร่างกายได้ 2 ช่องทางหลักคือการกลืนและการหายใจ ในผู้ที่ได้รับการบูรณะฟันด้วยวัสดุอะมัลกัม การกลืนเอาเศษวัสดุอะมัลกัมขณะที่ทันตแพทย์บูรณะ ขัดแต่ง รื้อวัสดุอะมัลกัมเก่า หรือวัสดุอะมัลกัมในช่องปากมีการแตกหักตามขอบหรือแตกหักทั้งชิ้น การกร่อน (corrosion) ของอะมัลกัมที่ผ่านการใช้งานในช่องปาก ทำให้มีปรอท (Hg2+) ออกมาอยู่ในน้ำลายและกลืนกินเข้าไป ทั้งนี้อะมัลกัมที่มีใช้ในปัจจุบันมีการปรับปรุงคุณสมบัติโดยมีการเพิ่มปริมาณของทองแดง ทำให้วัสดุอะมัลกัมมีคุณสมบัติที่ดีมากขึ้นคือจะไม่มีส่วนที่เป็น tin-mercury (gamma 2-phase) ซึ่งเป็นส่วนที่มีการกร่อนและปลดปล่อยปรอทออกมามากที่สุด ทำให้หายใจเอาไอปรอท (elemental mercury vapor: Hg0) ซึ่งปรอทเป็นโลหะที่สามารถระเหยเป็นไอได้ ณ อุณหภูมิห้องและร่างกาย (Hg0 vapor pressure = 0.0013 mm 20 C) อย่างไรก็ตาม การปลดปล่อยของปรอทออกจากอะมัลกัมที่ก่อตัวแล้วจะลดลงตามเวลา แต่ในขั้นตอนการทำงานบูรณะฟันบางขั้นตอนอาจจะทำให้การปลดปล่อยไอปรอทออกมาเพิ่มมากขึ้น เช่น การขัดแต่งวัสดุอะมัลกัมโดยไม่ใช้น้ำ หรือการรื้อวัสดุอะมัลกัม Berglund และ Molin ในปี ค.ศ. 1997 วัดระดับของปรอทในพลาสมาและปัสสาวะภายหลังจากการรื้อวัสดุอะมัลกัม เปรียบเทียบระหว่างกลุ่มที่ใส่และไม่ใส่แผ่นยางกั้นน้ำลาย พบว่าเฉพาะกลุ่มที่ไม่ใส่แผ่นยางกั้นน้ำลายที่มีระดับปรอทในพลาสมาและปัสสาวะเพิ่มขึ้นอย่างมีนัยสำคัญทางสถิติ (Roberts and Charlton 2009)
สัดส่วนปรอทจากวัสดุอะมัลกัมเข้าสู่ร่างกาย ประมาณร้อยละ 40 ในรูปแบบของการกลืนกิน (Hg2+) ผ่านระบบทางเดินอาหาร ประมาณร้อยละ 60 ผ่านทางระบบทางเดินหายใจ (Hg0) อย่างไรก็ตามปริมาณของปรอทจากวัสดุอะมัลกัมที่ถูกปลดปล่อยออกและเข้าสู่ร่างกายในแต่ละบุคคลนี้มีความแตกต่างกันขึ้นอยู่กับ จำนวนฟันที่ถูกบูรณะด้วยวัสดุอะมัลกัม ขนาดของวัสดุบูรณะ ปฏิกริยากัลวานิก การบดเคี้ยว การแปรงฟัน หลายการศึกษาวัดปริมาณของไอปรอทในช่องปากที่ปลดปล่อยออกจากวัสดุอะมัลกัม ด้วยวิธีการต่าง ๆ กัน (ตารางที่ 1) (Roberts and Charlton 2009) ทำให้เปรียบเทียบปริมาณระหว่างการศึกษาได้ค่อนข้างยาก
ตารางที่ 1: Daily mercury vapor exposure relative to number of existing amalgam surfaces
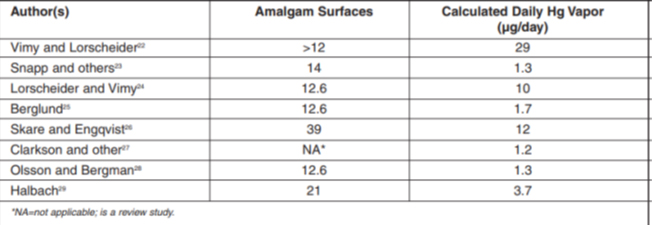
ปริมาณปรอทจากวัสดุอะมัลกัมที่ได้รับมีค่าเฉลี่ยประมาณ 2-5 μg ต่อวัน สำหรับผู้ใหญ่ที่มีวัสดุอะมัลกัมเฉลี่ย 8 ซี่ และ 0.3 μg ต่อวัน สำหรับเด็กอายุ 12 ปี ซึ่งมีวัสดุอะมัลกัมเฉลี่ย 0.5 ซี่ อย่างไรก็ตามปริมาณปรอทจากวัสดุอะมัลกัมที่เข้าสู่ร่างกายจัดเป็นปริมาณที่น้อยมาก เมื่อเปรียบเทียบกับปรอทที่ได้รับจากอาหารซึ่งมีค่าเฉลี่ย 15 μg ต่อวัน และปริมาณปรอทที่ร่างกายดูดซึมได้มีค่าเฉลี่ยต่อวัน 5.8 μg (Spencer 2000) ปริมาณเฉลี่ยของปรอทจากวัสดุอะมัลกัมที่ดูดซึม โดยเข้าสู่ร่างกายทางการหายใจ 1-2 μg ต่อวันและน้อยกว่า 1.5 μg ต่อวันทางการกลืน (Mackert and Berglund 1997) การศึกษาของ Berglund ในปี ค.ศ.1990 ซึ่งวัดปริมาณไอปรอทในระยะเวลา 24 ชม. ของผู้ที่มีวัสดุอะมัลกัมในช่องปากอย่างน้อย 9 ซี่ พบว่าปริมาณไอปรอทเฉลี่ยที่หายใจเท่ากับ 1.7 μg (0.4 - 4.4 μg) ซึ่งคิดเป็นเพียงร้อยละ 1 ของระดับปรอทสูงสุด (threshold limit) ที่กำหนดโดยองค์การอนามัยโลก (WHO) 300 - 500 μg ต่อวัน และระดับปรอทในสิ่งแวดล้อมที่ทำงานสูงสุด 50 μg ต่อวัน (Pant, Rathore, and Singh 2012) ถึงแม้ว่าระดับของปรอทในเลือดหรือปัสสาวะของผู้ที่มีวัสดุอะมัลกัมจะสูงกว่าผู้ที่ไม่มีวัสดุอะมัลกัม แต่ก็เป็นความต่างในปริมาณที่น้อยมาก เช่น การศึกษาในอาสาสมัครจำนวน 1,100 คน พบว่าวัสดุบูรณะอะมัลกัม 10 ด้านจะทำให้ระดับของปรอทในปัสสาวะเพิ่มขึ้นเพียง 1 μg/L (Roberts and Charlton 2009) ปัจจุบันยังไม่มีการศึกษาหรือหลักฐานทางวิชาการที่มากพอจะสรุปได้ว่าปริมาณของปรอทจากวัสดุ อะมัลกัมจะเป็นสาเหตุโดยตรงหรือเป็นอันตรายต่อสุขภาพ นอกจากปฏิกริยาอาการแพ้ ถึงแม้ว่าจะมีหลาย ๆ การศึกษาทั้งในสัตว์ทดลอง การศึกษาทางคลินิก การศึกษาระบาดวิทยาได้รายงานความสัมพันธ์ของการมีวัสดุบูรณะอะมัลกัมในช่องปากกับระดับปรอทที่สูงขึ้นในเลือด ปัสสาวะ หรือเนื้อเยื่อต่าง ๆ รวมทั้งอาการเจ็บป่วยเรื้อรังทางร่างกายที่หาสาเหตุไม่ได้
ผลข้างเคียงอันไม่พึงประสงค์ที่จะเกิดขึ้นได้กับผู้ที่มีวัสดุอะมัลกัม (Adverse effects in individuals with amalgam restorations)
ปฏิกริยาตอบสนองเฉพาะที่ต่อเนื้อเยื่อในช่องปาก (Localized mucosal reactions)
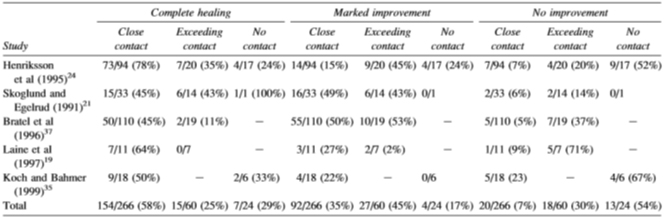
วัสดุอะมัลกัมเป็นสาเหตุภาวะภูมิแพ้แบบล่าช้าได้ (delayed type hypersensitivity) ซึ่งผู้ป่วยเองอาจจะไม่สังเกตหรือไม่มีอาการจากอาการแพ้ที่พบในช่องปากหรือรอยโรคไลเคนอยด์ (oral lichenoid lesions) ซึ่งจัดเป็นการอักเสบอย่างเรื้อรัง แต่อย่างไรก็ตามวัสดุบูรณะชนิดอื่น ๆ ก็สามารถทำให้เกิดปฏิกริยาตอบสนองนี้ได้เช่นกัน การศึกษาที่ผ่านมารายงานความชุกของการแพ้ต่อวัสดุบูรณะทางทันตกรรมว่าเกิดขึ้นได้ร้อยละ 13-60 การศึกษาในประเทศไทยโดย Thanyavuthi และคณะ ในผู้ป่วยที่พบรอยโรคไลเคนอยด์ จำนวน 53 รายตั้งแต่ปี ค.ศ. 2002 ถึง 2014 พบว่าร้อยละ 90.5 ของรอยโรคไลเคนอยด์ในช่องปากมีความสัมพันธ์กับวัสดุอะมัลกัม ตำแหน่งที่พบบ่อยคือบริเวณเนื้อเยื่อกระพุ้งแก้ม (ร้อยละ 90.6) ลิ้น (ร้อยละ 20.8) ริมฝีปาก (ร้อยละ 18.9) เหงือก (ร้อยละ 11.3) และเพดานปาก (ร้อยละ 3.8) รอยโรคไลเคนอยด์แบบ reticulated white patch พบได้บ่อยที่สุด (ร้อยละ 79.5) ตามด้วยแบบ erosive หรือ atrophic (ร้อยละ 17.9) และ ulcerative (ร้อยละ 2.6) ผลทดสอบการแพ้ (patch test) ในผู้ป่วยเหล่านี้ให้ผลบวกร้อยละ 73.6 และสัมพันธ์กับอาการทางคลินิกร้อยละ 76.9 ในกลุ่มของสารทดสอบการแพ้ ผู้ป่วยมีการแพ้ต่อปรอทมากที่สุด (ร้อยละ 35.8) copper sulfate (ร้อยละ 32) nickel (ร้อยละ 28.3) และ gold sodium thiosulfate (ร้อยละ 28.3) ผู้ป่วยที่มีอาการแพ้และได้รับการเปลี่ยนวัสดุบูรณะเป็นเรซิน คอมโพสิต มีอาการของรอยโรคดีขึ้น (Thanyavuthi, Boonchai, and Kasemsarn 2016) ผู้ที่มีวัสดุอะมัลกัมในช่องปากมีโอกาสเกิดการแพ้หรือปฏิกริยาตอบสนองต่ออะมัลกัมได้น้อยกว่าร้อยละ 0.3 และอาการนี้หายไปเมื่อเปลี่ยนวัสดุบูรณะ จากการทบทวนวรรณกรรมของ Issa และคณะในปี ค.ศ. 2004 ผู้ป่วยจำนวน 1,158 คนจาก 19 การศึกษา เมื่อทดสอบการแพ้ ร้อยละ 16-91 ให้ผลทดสอบว่าแพ้สารทดสอบที่มีปรอทเป็นองค์ประกอบอย่างน้อย 1 ชนิด สำหรับผู้ที่ได้รับการเปลี่ยนวัสดุอะมัลกัม มีการหายของรอยโรคไลเคนอยด์อย่างสมบูรณ์ร้อยละ 37.5 - 100 โดยกลุ่มที่มีรอยโรคสัมผัสโดยตรงกับอะมัลกัมมีสัดส่วนของผู้ป่วยที่มีอาการของรอยโรคดีขึ้นมากที่สุด (ตารางที่ 2) (Issa et al. 2004)
ข้อสรุปจากรายงานของ Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR) กล่าวว่าการมีวัสดุอะมัลกัมที่อยู่ในช่องปากไม่เป็นภาวะเสี่ยงต่อสภาวะสุขภาพในประชากรทั่วไป ดังนั้นจึงไม่มีความจำเป็นที่จะต้องเปลี่ยนวัสดุอะมัลกัมเพื่อเป็นการป้องกันผลข้างเคียงต่อสภาวะสุขภาพ รวมทั้งเป็นการลดโอกาสที่ผู้ป่วยจะสัมผัสกับไอปรอทในขณะที่มีการรื้อวัสดุอะมัลกัมอีกด้วย (Rodríguez-Farre et al. 2016)
ตารางที่ 2: Healing of oral lichenoid lesions regarding their topographical relationships with amalgam restorations
ผลทางระบบ (Systemic effects)
หลายการศึกษารายงานความสัมพันธ์ของจำนวนวัสดุอะมัลกัมกับระดับปรอทในปัสสาวะ แต่ระดับที่เพิ่มขึ้นไม่มีนัยสำคัญทางคลินิกหรือเป็นระดับที่เป็นอันตรายต่อไต (MacRitchie et al. 2012) การศึกษาในเด็กที่ติดตามผลระยะยาว 7 ปี โดย Lauterbach และคณะ ในปี ค.ศ. 2008 ได้แสดงให้เห็นว่าค่า creatinine adjusted urinary mercury ในเด็กที่มีวัสดุอะมัลกัมสูงขึ้นเล็กน้อยใน 2 ปีแรก มีค่าโดยเฉลี่ย 1.5 μg/L และลดลงเหลือ 1.0 μg/L หรือน้อยกว่าหลังจากนั้น การขับออกของปรอททางปัสสาวะของเพศหญิงจะมีค่าเฉลี่ยสูงกว่าเพศชาย อย่างไรก็ตาม ค่านี้ไม่ได้แตกต่างจากช่วงค่าปกติของคนทั่วไปที่ไม่สัมผัสปรอท (0-4 μg/L)
สำหรับผลต่อระบบประสาท หลายการศึกษาทั้งในอาสาสมัครที่เป็นแฝด ผู้สูงอายุและเด็ก ไม่พบว่าจำนวนอะมัลกัมในช่องปากมีความสัมพันธ์กับการทำงานของระบบประสาท เช่น การทดสอบความจำ (memory function) สมรรถนะของการรู้คิด (cognitive function) โรคอัลไซเมอร์ (Alzheimer’s disease) ผลการเรียน ผลต่อประสาทจิตวิทยา (neuropsychological effects) (Roberts and Charlton 2009)
การศึกษาเชิงทดลองในเด็กอายุ 6-10 ปี เป็นระยะเวลา 5 ปี โดย Bellinger และคณะ ในปี ค.ศ. 2006 ซึ่งติดตามผลกระทบของปรอทในวัสดุอะมัลกัมต่อการทำงานของระบบประสาทสรีวิทยา (neurophysiology) และไต (renal function) ไม่พบความแตกต่างของค่า IQ memory index และ urinary albumin ในเด็กที่ได้รับการบูรณะฟันด้วยวัสดุอะมัลกัมและเรซินคอมโพสิต การศึกษาเชิงทดลองอื่น ๆ ก็ให้ผลไปในทำนองเดียวกันว่า ไม่พบความสัมพันธ์ระหว่างระดับปรอทจจากอะมัลกัมกับ neuropsychological outcomes หรืออาการอื่นของระบบประสาทเช่น abnormal tremor, coordination, gait, strength sensation, muscle stretch reflexes และ peripheral neuropathy
การศึกษาถึงผลของปรอทจากวัสดุอะมัลกัมต่อระบบภูมิคุ้มกัน บางการศึกษาไม่พบความสัมพันธ์ระหว่างวัสดุอะมัลกัมกับจำนวนของ lymphocyte บางการศึกษาที่มีการรื้อวัสดุอะมัลกัมออกจากผู้ป่วยที่อ้างว่ามีอาการเจ็บป่วยจากวัสดุอะมัลกัม พบว่าผู้ป่วยเหล่านั้นส่วนใหญ่มีการแพ้โลหะและพบระดับ IgE ลดลงหลังจากรื้อวัสดุอะมัลกัม (Roberts and Charlton 2009) การศึกษาผลข้างเคียงในผู้ป่วยที่มีโรคเกี่ยวกับภูมิคุ้มกันและภูมิแพ้ เช่น systemic lupus, multiple sclerosis, autoimmune thyroiditis, หรือ atopic eczema ที่มีวัสดุบูรณะอะมัลกัม จำนวน 35 ราย โดยการทดสอบในห้องปฏิบัติการพบว่าปรอทในปริมาณต่ำ ๆ จะเพิ่มระดับการกระตุ้น lymphocyte และเมื่อมีการเปลี่ยนวัสดุบูรณะเป็นชนิดอื่นพบว่าระดับการกระตุ้นของ lymphocyte ลดลง รวมทั้งผู้ป่วยส่วนใหญ่ (ร้อยละ 71) รายงานว่ามีสภาวะสุขภาพร่างกายดีขึ้น โดยเฉพาะผู้ป่วย multiple sclerosis (Prochazkova et al. 2004)
การศึกษาในผู้ใหญ่ของประเทศนิวซีแลนด์ จำนวน 20,000 คนโดย Bate และคณะ ในปี ค.ศ. 2004 ไม่พบความสัมพันธ์อย่างมีนัยสำคัญทางสถิติของการมีวัสดุอะมัลกัมในช่องปากกับระบบประสาทและการทำงานของไตเช่นเดียวกัน แต่พบความชุกของการเกิด multiple sclerosis มากกว่าเล็กน้อย ซึ่งอาจเป็นผลจากตัวแปรกวน (confounding factors) การศึกษาทางระบาดวิทยาแบบมีกลุ่มควบคุม (case control) ในไต้หวัน พบว่าผู้ที่ได้รับการบูรณะด้วยอะมัลกัมในช่วงปี ค.ศ. 2000-2008 มีความเสี่ยงต่อการเกิดโรคพาร์กินสันมากกว่าผู้ที่ไม่ได้รับการบูรณะด้วยวัสดุอะมัลกัมในช่วงเวลาดังกล่าวมากกว่าเป็น 1.583 เท่า อย่างไรก็ตาม การศึกษานี้มีข้อจำกัดหลายประการและมีความเสี่ยงต่อการเกิดอคติลำเอียง เช่น ไม่มีข้อมูลของการได้รับปรอทจากแหล่งอื่น หรือโลหะหนักชนิดอื่น ผู้ป่วยส่วนใหญ่ได้รับการวินิจฉัยโรคพาร์กินสัน ในเวลา 2 ปีภายหลังจากได้รับการบูรณะด้วยอะมัลกัม ซึ่งมีความเป็นไปได้น้อยที่ปรอทจะเป็นสาเหตุให้เกิดโรคพาร์กินสันภายในระยะเวลาอันสั้น (Hsu et al. 2016)
หลายการศึกษาได้สรุปว่าอาการทางร่างกายของผู้ป่วย คำบ่นเกี่ยวกับความเจ็บป่วยทางร่างกายของผู้ป่วยจากวัสดุอะมัลกัม (amalgam illness) เกี่ยวข้องกับปัจจัยทางด้านสภาพจิตใจ (psychosocial) มากกว่ามากกว่าความเป็นพิษของปรอทจากวัสดุอะมัลกัม ในผู้ป่วยบางรายที่มีความผิดปกติด้านจิตใจกลับพบว่ามีระดับของปรอทในเลือดต่ำกว่าผู้ที่ไม่มีอาการดังกล่าว (Pant, Rathore, and Singh 2012; Bailer et al. 2001; Roberts and Charlton 2009) หรือทำการรื้ออะมัลกัมออกหมดแล้วอาการเจ็บป่วยก็ยังไม่ดีขึ้น จากการทบทวนวรรณกรรม มีการรายงานถึงความสัมพันธ์ระหว่างการสัมผัสสารปรอทจากวัสดุอะมัลกัมกับอาการแสดงทางร่ายกายอื่น ๆ เช่น การเจ็บป่วยเรื้อรัง ความล้า ความเครียดและกังวล อาการปวดกล้ามเนื้อ รวมถึงการฆ่าตัวตาย อย่างไรก็ตาม ยังไม่สามารถอธิบายกลไกของความสัมพันธ์ได้อย่างชัดเจน (Kern et al. 2014)
ผลต่อพันธุกรรม (Genetic effects)
การศึกษาแบบมีกลุ่มควบคุม เพื่อประเมินถึงผล genotoxicity ของวัสดุบูรณะต่าง ๆ (วัสดุอะมัลกัม เรซินคอมโพสิต และมีวัสดุบูรณะทั้งสองชนิดในช่องปาก) เก็บตัวอย่างเลือดจากผู้เข้าร่วมวิจัยจำนวน 68 คน พบว่าผู้ที่มีวัสดุบูรณะในช่องปากจะมีการเปลี่ยนแปลงของ DNA (Tail length, percentage of DNA in the tail, tail movement or Olive tail movement) เป็นสองเท่าของกล่มุควบคุมหรือกลุ่มไม่มีวัสดุบูรณะในช่องปาก แต่ไม่พบความแตกต่างระหว่างผู้ที่มีวัสดุบูรณะ (Di Pietro et al. 2008)
ผู้ที่มียีนหรือสารพันธุกรรมบางอย่างมีความเสี่ยงที่จะได้รับความเป็นพิษของสารปรอท (Genetic predisposition of individuals and sub-populations)
มีการศึกษาที่ได้แสดงให้เห็นถึงความเกี่ยวข้องกันระหว่างผลของปรอทกับ polymorphisms ของยีนหลายตัว ทั้งในสัตว์ทดลองและในมนุษย์ ซึ่งงานวิจัยในมนุษย์ที่สำคัญและได้รับการกล่าวถึงมากคือการนำข้อมูลการวิจัยแบบทดลองแบบสุ่มการบูรณะฟันด้วยอะมัลกัมในเด็กของ Casa Pia’s amalgam trial จำนวน 330 คน มาวิเคราะห์ใหม่โดย Woods และคณะ ปี ค.ศ. 2012, 2013, 2014 ผลการศึกษาได้แสดงให้เห็นว่าการแปรผันทางพันธุกรรม (genetic variant) ของยีนหลายตัวมีความสัมพันธ์กับความไวที่จะได้รับพิษจากปรอทในเด็กที่อาจจะส่งผลต่อผลการทดสอบทางประสาทพฤติกรรม (neurobehaviors) โดยเฉพาะในเด็กผู้ชาย ได้แก่ CPOX4 metallothionein และ catechol-Omethyltransferase (COMT)
นอกจากนี้มีการศึกษาที่แสดงถึงความสัมพันธ์ของปรอทกับ polymorphisms ของยีน glutathione ซึ่งเป็นยีนที่เกี่ยวข้องกับกระบวนการเพิ่ม oxidative stress และลดลงของ antioxidant defenses การศึกษาของ Barcelos และคณะ (2013) ศึกษา polymorphisms ของยีน 2 ตัวคือ glutamyl cysteine ligase (GCL) และ glutathione S-transferase (GST) ในประชากรอะเมซอน (Amazonian population) ที่ได้รับ methyl-Hg จากปลา ผู้วิจัยพบว่ามีเฉพาะบาง polymorphisms ของทั้ง GCL และ GST ที่เกี่ยวข้องกับระดับของปรอทในเลือด เส้นผม และ polymorphism ของ GST เกี่ยวข้องกับ catalase activity อีกการศึกษาของยีน GCL และ GST ในประชากรสวิสเซอร์แลนด์ที่ได้รับ methyl-Hg จากปลา โดย Custodio และคณะ (2004) พบว่า polymorphism ของยีนทั้งสองมีความสัมพันธ์กับระดับปรอท พบความถี่ของ polymorphism ร้อยละ 13 และ 16 ตามลำดับ ในการศึกษาต่อมาของ Custodio และคณะ (2005) ในคนงานเหมืองทอง จำนวน 309 คน พบว่า GCL polymorphism มีความสัมพันธ์กับระดับปรอทในเลือด พลาสมาและปัสสาวะที่สูงขึ้น อธิบายกลไกได้ว่า GCL polymorphism นี้จะทำให้การผลิต glutathione ลดลงซึ่งจะทำให้ conjugation และ biliary excretion ของปรอทลดลง พบความถี่ของ polymorphism ร้อยละ 41 สำหรับ heterozygous variant และร้อยละ 10 สำหรับ homozygous variant (Kern et al. 2014)
บทสรุป
ปรอทเป็นองค์ประกอบหลักอย่างหนึ่งในวัสดุบูรณะฟันชนิดอะมัลกัม ความเสี่ยงต่อการทำให้เกิดพิษขึ้นกับลักษณะรูปแบบและวิธีการที่ได้รับเข้าสู่ร่างกาย การลดการใช้สารปรอทลงเป็นประโยชน์ต่อมวลมนุษยชาติทั้งในด้านการลดการรับเข้าสู่ร่างกาย และผลต่อสิ่งแวดล้อม อย่างไรก็ดี จนถึงปัจจุบัน ยังไม่สามารถหาข้อสรุปและหลักฐานทางวิทยาศาสตร์ที่เด่นชัดหนักแน่นและเป็นที่ยอมรับได้ว่าอะมัลกัมส่งผลเสียต่อสุขภาพ หลักฐานที่แสดงการเชื่อมโยงว่าอะมัลกัมมีผลกระทบต่อสุขภาพนั้นค่อนข้างอ่อน เพราะมีการรายงานการศึกษาที่ขัดแย้งกันค่อนข้างมาก เช่น วิธีการประเมินหรือวัดปริมาณปรอทที่ไม่เหมาะสม ส่วนใหญ่แสดงเป็นปริมาณสารปรอทต่อของเหลวทั้งหมดในร่างกาย ไม่มีการแยก form ว่าเป็น organic หรือ inorganic และไม่แยกแหล่งที่มา เช่น มาจากอาหาร หรือมาจากวัสดุบูรณะฟัน หรือมาจากแหล่งอื่น หลายๆการศึกษาแสดงค่าที่ได้มาจากการเข้าสูตรคำนวณโดยที่ไม่ได้วัดปริมาณจริง ซึ่งการศึกษาทั้งหลายก็ได้รวมประชากรหลากหลายลักษณะ รวมถึง เด็ก สตรีมีครรภ์ และสตรีในระยะกำลังให้นมบุตร สำหรับกลุ่มประชากรย่อยที่น่าจะเป็นกลุ่มเสี่ยงเนื่องมาจากลักษณะต่างทางพันธุกรรมนั้น จำเป็นต้องมีการศึกษากันต่อไปก่อนที่จะมีข้อสรุปใดๆออกมา จึงอาจกล่าวสรุปโดยกว้างๆว่า การใช้วัสดุอะมัลกัมบูรณะฟันนั้นไม่ได้เพิ่มความเสี่ยงต่อการเกิดโรค ต่อสุขภาพ หรือผลข้างเคียงไม่พึงประสงค์ทางร่างกายต่อผู้ป่วย แต่ต้องพึงตระหนักว่า มีการพบการตอบสนองเฉพาะที่ (local adverse effects) ได้บ้างแต่ไม่มากนัก และสามารถจัดการรักษาได้โดยไม่ยุ่งยาก นอกจากนี้ อาการแพ้สารปรอท ตลอดจนการแพ้อะมัลกัม สามารถพบได้ แม้ยังไม่สามารถอธิบายได้ว่าเหตุใดบางคนจึงแพ้ง่ายกว่าคนอื่นๆ พบว่ามีการปลดปล่อยไอปรอทขณะที่ทำการบูรณะฟันหรือทำการรื้ออะมัลกัม ทำให้เกิดภาวะที่ทั้งผู้ป่วยและทันตบุคคลากรได้รับสารปรอทแบบชั่วคราว ดังนั้น จึงไม่มีความจำเป็นใดๆเลยที่ควรกรอรื้ออะมัลกัมที่มีสภาพทางคลินิกดีๆออกจากฟันผู้ป่วย ยกเว้น ในกรณีที่ผู้ป่วยนั้นได้รับการวินิจฉัยว่าแพ้อะมัลกัมหรือองค์ประกอบของอะมัลกัม ถึงแม้ว่าผลการศึกษาต่างๆไม่ได้ขัดขวางการใช้อะมัลกัมเพื่อการบูรณะฟันในประชากรทั่วไป ในสตรีมีครรภ์ การบูรณะฟันหรือการให้หัตถการใดๆก็ตามควรทำอย่างจำกัดมากที่สุดเพื่อลดผลกระทบต่อทารกในครรภ์ จึงอาจกล่าวได้ว่า การเลือกวิธีและวัสดุในการบูรณะฟันน่าจะพิจารณาหลายองค์ประกอบ เช่น ฟันแท้หรือฟันน้ำนม ตั้งครรภ์หรือไม่ มีอะมัลกัมจำนวนมากในปากอยู่แล้วหรือไม่ ปรากฎร่องรอยหรือมีประวัติเรื่องการแพ้อะมัลกัมหรือวัสดุอื่นๆหรือไม่ มีปัญหาเรื่องการทำงานของไตหรือไม่ เป็นต้น
ในส่วนของทันตบุคคลากร เป็นที่ยอมรับว่าได้รับสารปรอทมากกว่าคนทั่วไปเพราะเป็นการได้รับเนื่องจากสายอาชีพ อย่างไรก็ดี การรายงานเรื่องผลกระทบต่อสุขภาพ ไม่ได้พบว่ามีความแตกต่างไปจากประชากรทั่วไป อย่างไรก็ดี มาตรการระมัดระวังการใช้สารปรอทที่ใช้ในผู้ป่วย ควรนำมาใช้กับทันตบุคคลากรด้วยเช่นกัน และเพื่อเป็นการลดการใช้สารปรอทลงเพื่อตอบสนองต่ออนุสัญญามินามาตะในการลดสารปรอทสู่สิ่งแวดล้อม อาจกล่าวได้ว่าในการพิจารณาบูรณะฟันเป็นครั้งแรกในเด็ก และการบูรณะฟันในสตรีมีครรภ์ อาจพิจารณาใช้วัสดุทางเลือกเป็นลำดับแรก และการตัดสินใจนี้ต้องแจ้งให้ผู้ป่วย และ/หรือ ผู้ปกครองได้รับทราบด้วย วัสดุทางเลือกเองก็มีองค์ประกอบเป็นสารเคมีหลากหลายชนิด องค์ความรู้เรื่องความเป็นพิษและผลข้างเคียงที่ไม่พึงประสงค์ควรได้รับการพิจารณาอย่างถี่ถ้วนเช่นกัน
เอกสารอ้างอิง
- Aaseth J et al. Mercury exposure and health impacts in dental personnel. Environmental research. 2018;164:65-9.
- Akiyama M et al. Genotoxicity of mercury used in chromosome aberration tests. Toxicol Vitr. 2001;15(4–5):463–7.
- Al-Saleh I et al. Effect of mercury (Hg) dental amalgam fillings on renal and oxidative stress biomarkers in children. Sci Total Environ. 2012; 431: 188-96.
- Al-Zubaidi ES, Rabee AM. The risk of occupational exposure to mercury vapor in some public dental clinics of Baghdad city, Iraq. Inhalation toxicology. 2017;29(9):397-403.
- American Conference of Governmental Industrial Hygienists, “Mercury, All form except alkyl,” Chemical Substances, 7th Edition, pp. 1-13, ACGIH, Cincinnati, OH, 2001.
- American Conference of Governmental Industrial Hygienists (ACGIH) Documentation of the Biological Exposure Indices (7th Edition). Mercury – Elemental and Inorganic. ACGIH Worldwide, 1330 Kemper Meadow Drive, Cincinnati, Ohio, 2007.
- Aminzadeh KK, Etminan M. Dental amalgam and multiple sclerosis: a systematic review and meta-analysis. J Public Health Dent [Internet]. 2007;67(1):64–6. Available from: http://www.ncbi.nlm.nih.gov/pubmed/17436982
- Anneroth G et al. Comprehensive medical examination of a group of patients with alleged adverse effects from dental amalgams. Acta Odontol Scand. 1992;50(2):101–11.
- Atesagaoglu A et al. Mercury exposure in dental practice. Oper Dent. 2006; 31-6: 666-9.
- Bailer J et al. Adverse health effects related to mercury exposure from dental amalgam fillings: Toxicological or psychological causes? Psychol Med. 2001;31(2):255–63.
- Bates MN et al. Health effects of dental amalgam exposure: A retrospective cohort study. Int J Epidemiol. 2004;33(4):894–902.
- Bayne SC et al. The Challenge for Innovation in Direct Restorative Materials. Adv Dent Res. 2013; 25(1):8-17.
- Begerow J et al. Long-term mercury excretion in urine after removal of amalgam fillings. Int Arch Occup Environ Health. 1994; 66:209-212.
- Bellinger DC et al. Neuropsychological and renal effects of dental amalgam in children: a randomized clinical trial. JAMA. 2006;295(15):1775-83.
- Bellinger, D.C. et al., “A Dose-Effect Analysis of Children’s Exposure to Dental Amalgam and Neuropsychological Function: The New England Children’s Amalgam Trial,” Journal of the American Dental Association, 2007;138:1210-16.
- Berglund A et al. Mercury levels in plasma and urine after removal of all amalgam restorations: The effect of using rubber dams. Dent Mater 1997 September; 13: 297-304.
- Bjornberg KA et al. Transport of methylmercury and inorganic mercury to the fetus and breast-fed infant. Environ Health Perspect 2005; 113:1381-5.
- Bratel J et al. Effect of replacement of dental amalgam on oral lichenoid reactions. J Dent. 1996;24(1–2):41–5.
- Brownawell AM et al. The potential adverse health effects of dental amalgam. Toxicol Rev. 2005;24(1):1–10.
- da Costa SL et al. Breast-Milk Mercury Concentrations and Amalgam Surface in Mothers from Brasilia, Brazil. Biol Trace Elem Res. 2005 Aug;106(2):145-51.
- Daniels JL et al. ALSPAC Study Team. Maternal dental history, child's birth outcome and early cognitive development. Paediatr Perinat Epidemiol. 2007; 21: 448–57.
- Decharat S et al. Determination of mercury exposure among dental health workers in Nakhon Si Thammarat Province, Thailand. Journal of toxicology. 2014;2014.
- Duncan A et al. Thirty-five year review of a mercury monitoring service for Scottish dental practices. British dental journal. 2011;210(3):E2.
- Department of Health and Human Services. Final Rule. Federal Register 75: Issue 112 (Friday, June 11, 2010). Available at: http://www.fda.gov/downloads/medicaldevices/productsandmedicalprocedures/dentalproducts/dentalamalgam/ucm174024.pdf. Accessed August 4, 2018.
- De Rouen, T. et al., “Neurobehavioral Effects of Dental Amalgam in Children, A Randomized Clinical Trial,” Journal of the American Medical Association, 2006;295:1784-92.
- Di Pietro A et al. Biomonitoring of DNA damage in peripheral blood lymphocytes of subjects with dental restorative fillings. Mutat Res - Genet Toxicol Environ Mutagen. 2008;650(2):115–22.
- Drasch G. et al., “Mercury in human colostrum and early breast milk. Its dependence on dental amalgam and other factors,” J. Trace Elem. Med. Biol. 1998;12:23-27.
- Drexler, H. et al., “The mercury concentration in breast milk resulting from amalgam fillings and dietary habits,” Environmental Research 1998; 77:124-9.
- Dunsche A et al. Oral lichenoid reactions associated with amalgam: Improvement after amalgam removal. Br J Dermatol. 2003;148(1):70–6.
- Eley BM, Cox SW: Mercury from dental amalgam fillings in patients. Br Dent J. 1987; 163: 221–6.
- Ertas E et al. Human brain mercury levels related to exposure to amalgam fillings. Human and Experimental Toxicology. 2014;33(8):873-7.
- Factor-Litvak P et al. Mercury derived from dental amalgam and neuropsychologic function Environmental Health Perspectives. 2003 May;111(5):719-23.
- Hargreaves RJ, Evans JG, Janota I, Magos L, Cavanagh JB. Persistent mercury in nerve cells 16 years after metallic mercury poisoning. Neuropathol Appl Neurobiol. 1988;14(6):443-52.
- Henriksson E et al. Healing of lichenoid reactions following removal of amalgam: A clinical follow-up. J Clin Periodontol. 1995;22(4):287–94.
- Hilt B et al. Occurrence of cognitive symptoms in dental assistants with previous occupational exposure to metallic mercury. Neurotoxicology. 2009;30(6):1202-6.
- Holte H et al. Mercury Exposure in Dental Personnel. 2011.
- Homme KG et al. New science challenges old notion that mercury dental amalgam is safe. BioMetals. 2014;27(1):19–24.
- Hsu Y-C et al. Association between History of Dental Amalgam Fillings and Risk of Parkinson’s Disease: A Population-Based Retrospective Cohort Study in Taiwan. PLoS One [Internet]. 2016;11(12):e0166552. Available from: http://www.ncbi.nlm.nih.gov/pubmed/27906991
- Hujoel, P.P. et al., Mercury exposure from dental filling placement during pregnancy and low birth weight risk. American Journal of Epidemiology, 2005;161(8):734-740.
- Hursh JB, Cherian MG, Clarkson TW, Vostal JJ, Mallie RV. Clearance of mercury (HG-197, HG-203) vapor inhaled by human subjects. Arch Environ Health. 1976;31(6):302-9.
- HYGIENE GM. Dental mercury hygiene recommendations. 2003.
- Issa Y et al. Healing of oral lichenoid lesions after replacing amalgam restorations: A systematic review. Oral Surgery, Oral Med Oral Pathol Oral Radiol Endodontology. 2004;98(5):553–65.
- Jaisutthi S et al. Factors Influence the level of urinary mercury among dental staffs exposed to amalgam in community hospitals, Chanthaburi province. Journal of Medicine and Health Science. 2014;20(3):17-34.
- Kern JK et al. Evidence supporting a link between dental amalgams and chronic illness, fatigue, depression, anxiety, and suicide. Neuroendocrinol Lett. 2014;35(7):537–52.
- Kim K-H et al. A review on the distribution of Hg in the environment and its human health impacts. Journal of hazardous materials. 2016;306:376-85.
- Koch P, Bahmer FA. Oral lesions and symptoms related to metals used in dental restorations: A clinical, allergological, and histologic study. J Am Acad Dermatol. 1999;41(3):422–30.
- Levy M, Schwartz S, Dijak M, Weber JP, Tardif R, Rouah F. Childhood urine mercury excretion: dental amalgam and fish consumption as exposure factors. Environ Res. 2004;94(3):283-90.
- Luglie PF et al. of amalgam fillings on the mercury concentration in human amniotic fluid. Arch Gynecol Obstet 2005; 271:138-42.
- Lygre GB et al. Prenatal exposure to dental amalgam and pregnancy outcome. Community Dent Oral Epidemiol. 2016;44(5):442-9.
- Mackert JR, Berglund A. Mercury Exposure From Dental Amalgam Fillings: Absorbed Dose and the Potential for Adverse Health Effects. Crit Rev Oral Biol Med. 1997;8(4):410–36.
- McCullough MJ, Tyas MJ. Local adverse effects of amalgam restorations. Int Dent J. 2008;58(1):3–9.
- McParland H, Warnakulasuriya S. Oral Lichenoid contact lesions to mercury and dental Amalgam- A review. J Biomed Biotechnol. 2012;2012.
- Montebugnoli L et al. Clinical and histologic healing of lichenoid oral lesions following amalgam removal: A prospective study. Oral Surg Oral Med Oral Pathol Oral Radiol [Internet]. 2012;113(6):766–72. Available from: http://dx.doi.org/10.1016/j.oooo.2011.12.007
- Mutter J. Is dental amalgam safe for humans? The opinion of the scientific committee of the European Commission. J Occup Med Toxicol. 2011;6(1):1–17.
- Nerdrum P et al. A 7-year prospective quasi-experimental study of the effects of removing dental amalgam in 76 self-referred patients compared with 146 controls. J Psychosom Res. 2004;57(1):103–11.
- Ngim C, Ngim AD. Health and safety in the dental clinic–Hygiene regulations for use of elemental mercury in the protection of rights, safety and well-being of the patients, workers and the environment. Singapore dental journal. 2013;34(1):19-24.
- Nagpal N et al. A review of mercury exposure and health of dental personnel. Safety and Health at work. 2017;8(1):1-10.
- Oskarsson A. et al., “Total and inorganic mercury in breast milk in relation to fish consumption and amalgam in lactating women,” Archives of Environmental Health. 1996;51 (3): 234-41.
- Östman PO et al. Amalgam-associated oral lichenoid reactions Clinical and histologic changes after removal of amalgam fillings. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1996;81(4):459–65.
- Palkovicova L et al. Maternal amalgam dental fillings as the source of mercury exposure in developing fetus and newborn. Journal of Exposure Science and Environmental Epidemiology 2008; 18, 326–331; doi:10.1038/sj.jes.7500606; published online 12 September 2007.
- Powell P: Minamata disease: a story of mercury’s malevolence. South Med J. 1991; 84: 1352–8.
- Prochazkova J et al. The beneficial effect of amalgam replacement on health in patients with autoimmunity. Neuroendocrinol Lett. 2004;25(3):211–8.
- Richardson GM et al. Mercury exposure and risks from dental amalgam in the US population, post-2000. Science of the Total Environment 2011; (409): 4257-68.
- Roberts HW et al. The release of mercury from Amalgam restorations and its health effects: a review. Oper Dent. 2009; 34-5: 605-614.
- Sahani M et al. Mercury in dental amalgam: Are our health care workers at risk? Journal of the Air & Waste Management Association. 2016;66(11):1077-83.
- Sauder P, Livardjani F, Jaeger A, et al: Acute mercury chloride intoxication. Effects of hemodialysis and plasma exchange on mercury kinetic. J Toxicol Clin Toxicol. 1988; 26: 189–97.
- Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR) Scientific opinion on the Safety of Dental Amalgam and Alternative Dental Restoration Materials for Patients and Users. European Commission 2008.
- Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR) The safety of dental amalgam and alternative dental restoration materials for patients and users. European Commission. 2015.
- Sharma R et al. Role of dental restoration materials in oral mucosal lichenoid lesions. Indian J Dermatol Venereol Leprol. 2015;81(5):478–84.
- Shenker BJ et al. Immunotoxic effects of mercuric compounds on human lymphocytes and monocytes. II. Alterations in cell viability. Immunopharmacol Immunotoxicol. 1992;14(3):555-77.
- Sjursen TT et al. Patients’ experiences of changes in health complaints before, during, and after removal of dental amalgam. Int J Qual Stud Health Well-being [Internet]. 2015;10(1):28157. Available from: https://www.tandfonline.com/doi/full/10.3402/qhw.v10.28157
- Spencer AJ Dental amalgam and mercury in dentistry. Australian Dental Journal. 2000; 45(4): 224-34.
- Stehr-Green P: Autism and thimerosal-containing vaccines: lack of consistent evidence for an association. Am J Prev Med. 2003; 25: 101–6.
- Sunderman FW: Perils of mercury. Ann Clin Lab Sci. 1988; 18: 89–101.
- Sun Y-H et al. Association between dental amalgam fillings and Alzheimer’s disease: a population-based cross-sectional study in Taiwan. Alzheimers Res Ther [Internet]. 2015;7(1):65. Available from: http://alzres.com/content/7/1/65
- Svare CW et al. The effect of dental amalgams on mercury levels in expired air. J Dent Res. 1981;60(9):1668-71.
- Thanyavuthi A et al. Amalgam Contact Allergy in Oral Lichenoid Lesions. Dermatitis. 2016;27(4):215–21.
- Vimy M.J. et al., “Mercury from maternal "silver" tooth fillings in sheep and human breast milk: A source of neonatal exposure,” Biol. Trace Elem. Res. 1997, Vol. 56 (2), pp.143-52.
- Visalli G et al. Genotoxic damage in the oral mucosa cells of subjects carrying restorative dental fillings. Arch Toxicol. 2013;87(1):179–87.
- Watson GE et al. Prenatal exposure to dental amalgam: evidence from the Seychelles child development main cohort. J Am Dent Assoc 2011; 142:1283–94.
- Watson GE et al. Prenatal exposure to dental amalgam in the Seychelles Child Development Nutrition Study: Associations with neurodevelopmental outcomes at 9 and 30 months. Neurotoxicology 2012; 33: 1511–7.
- Watson GE et al. Neurodevelopmental outcomes at 5 years in children exposed prenatally to maternal dental amalgam: The Seychelles Child Development Nutrition Study. Neurotoxicol Teratol 2013; 39:57–62.
- WHO, World Health Organization, CICAD 50 Elemental mercury and inorganic mercury compounds: human health aspects. Geneva, Switzerland: IPCS, World Health organization; 2003.
- WHO, World Health Organization Biological Monitoring of Chemical Exposure in the Workplace Guidelines. Geneva, Switzerland: IPCS, World Health organization; 1996.
- Woods, J.S. et al., “Biomarkers of Kidney Integrity in Children and Adolescents with Dental Amalgam Mercury Exposure: Findings from the Casa Pia Children’s Amalgam Trial,” Environmental Research, Vol. 108, pp. 393-99, 2008.
- Woods JS et al. Genetic polymorphisms affecting susceptibility to mercury neurotoxicity in children: Summary findings from the Casa Pia Children’s Amalgam Clinical Trial. Neurotoxicology [Internet]. 2014; 44: 288–302. Available from: http://dx.doi.org/10.1016/j.neuro.2014.07.010
- Ye BJ et al. Evaluation of mercury exposure level, clinical diagnosis and treatment for mercury intoxication. Ann Occup Environ Med. 2016; 28: 5. doi: 10.1186/s40557-015-0086-8. eCollection 2016.
- Yılmaz H, et al. Exposure to mercury among dental health workers in Turkey: correlation with amalgam work and own fillings. Toxicol Ind Health. 2015 Oct; 31(10): 951-4.
- Zimmer H et al. Determination of mercury in blood, urine, and saliva for the biological monitoring of an exposure from amalgam fillings in a group with self-reported adverse health effects. Int. J. Hyg. Environ. Health 2002; 205: 205-11.
- Zwicker JD et al. Longitudinal analysis of the association between removal of dental amalgam, urine mercury and 14 self-reported health symptoms. Environ Heal A Glob Access Sci Source. 2014; 13(1): 1–11.
- ธีระ ศิริบุรานนท์. ปริมาณปรอทในปัสสาวะของทันตบุคลากร. วารสารแพทย์เขต 7. 1998; 1: 113-9.
- สถาบันทันตกรรม กรมการแพทย์ กระทรวงสาธารณสุข. สาระสำคัญแนวทางปฏิบัติทางทันตกกรมในการใช้ปรอทอย่างปลอดภัย. 2008
